Количественный химический анализ
Физический смысл КР в том, что она показывает во сколько раз V1 > V2 или в сторону какой реакции смещено равновесие. Для аналитических целей чаще всего используют реакции, имеющие большую величину КР и практически нацело смещенные в прямом направлении.
Таблица 1. 4.1
Константы равновесия различных химических реакций
|
Химическая реакция |
Уравнение реакции |
Константа равновесия |
Название константы равновесия |
![]()
|
Диссоциация воды |
Н2ОН+ + ОН- |
Ионное произведение воды |
![]()
|
Диссоциация слабой кислоты |
HmAmН+ + Am- |
Константа диссоциации слабой кислоты |
![]()
|
Диссоциация слабогооснования |
M(OH)n Mn++ nOHm- |
Константа диссоциации слабого основания |
![]()
|
Диссоциация малорастворимого соединения |
MmAn mMn+ ++ nAm- |
Произведение растворимости |
![]()
|
Гидролиз |
MmAn+Н2ОM(OH)m + HnA |
Константа гидролиза |
![]()
|
Диссоциация комплексного иона |
[M(L)q] m Mn++qL p(m=n - qp) |
Константа нестойкости |
ЗДМ применим к реакциям диссоциации слабых электролитов (кислот, оснований, воды), осадков, комплексных веществ, процессам гидролиза и др. Во всех перечисленных случаях константы равновесия имеют специальные названия (табл. 1.4.1).К сильным электролитам ЗДМ неприменим. В растворах сильных электролитов существенную роль играет электростатическое взаимодействие ионов и их ассоциация. Вследствие этого в химических реакциях участвует только часть ионов сильного электролита, пропорциональная так называемой активности. Активность - это концентрация раствора сильного электролита, взятая с поправкой на межионное взаимодействие с помощью коэффициента активности:
a = с ,
где а - активность, моль/л;
- коэффициентактивности;
с - концентрация ионов в растворе без учета межионного взаимодействия, моль/л.
При разбавлении раствора сильного электролита с 0, 1, а с.
Значение коэффициента активности для различных электролитов при их различных концентрациях приведены в справочниках физико-химических величин, но могут быть и вычислены через ионную силу раствора I:
где сi и Zi - концентрация и заряд i-го иона раствора.
![]() при I 10-2;
при I 10-2;
![]() при I 10-1;
при I 10-1;
![]() при I 100
при I 100
ЗДМ для электролитов для вышеприведенной обратимой реакции записывается в форме:
![]()
Большинство химических реакций в количественном химическом анализе проводят в растворе, так как этот способ их осуществления наиболее прост и удобен.
Одной из основных характеристик растворов является концентрация. Концентрация - это величина, показывающая количественное содержание одного вещества в другом в относительных единицах, таких, как:
- процент (%), выражающий число частей данного вещества на 100 частей другого (или всего) вещества;
- промилле (‰, рm) - на тысячу частей;
- пропромилле (‰0, ррm) - на миллион частей;
- пробилле (рв) - на миллиард частей;
- кг/м³, г/см³, моль/дм³, кг/т и др.
Выражение концентрации через рm, ррm, рв используют в основном в фармацевтике (аптекарском деле).
В количественном химическом анализе наиболее часто используют массовую, молярную и процентную концентрации.
В качестве массовой концентрации широко применяется титр раствора. Различают “обыкновенный (простой)” и “условный” (по определяемому веществу) титры.
Простой титр (Т) равен отношению массы растворенного вещества Х к объему его раствора
![]() ,
,
где m(Х) и V(X) - масса вещества Х и объем его раствора соответственно.
В основном в качестве единицы Т(Х) используют г/см³ (г/мл), но иногда пользуются и производными единицами: кг/м³, мг/см³ и др. Выраженный в г/см³ титр показывает, сколько граммов вещества Х содержится в 1см³ его раствора.
Несмотря на одинаковую размерность, титр не следует путать с плотностью! Величина плотности раствора показывает массу одного см³ раствора, а не массу вещества в нем.
Титр по определяемому веществу Т(В/А), выраженный в г/см³, показывает, сколько граммов определенного вещества А взаимодействует с 1 см³ стандартного раствора вещества В.
![]() .
.
Условный титр с обыкновенным связан формулой перехода вида:
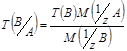 .
.
В аналитической химии используют две молярные концентрации: молярную концентрацию вещества и молярную концентрацию эквивалента вещества.
Другие рефераты на тему «Химия»:
- Синтезы на основе малонового эфира, кислоты Мельдрума и ацетоуксусного эфира
- Основы биохимии белков и аминокислот в организме человека
- Медь и её природные соединения, синтез малахита
- Научные основы технологии и оборудования гранулирования активных масс и формования положительных электродов литиевых источников тока
- Введение в теорию атома
