Физические основы электронных устройств
Медленные поверхностные состояния могут создаваться также атомами примеси, находящимися в самом окисле. Плотность медленных состояний значительно больше, чем быстрых (1017 — 1019м-2), и сильно зависит от их природы и состояния внешней среды.
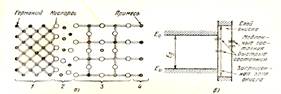
Рис. 3.3. Структура поверхностного слоя германия (а) и расположение быстрых и мед
ленных поверхностных состояний (изгиб зон у поверхности не показан) (б): 1 — германий; 2 — переходный слой; 3 — окисный слой; 4 — адсорбированные примеси.
3. Задача 1
Вычислить для температуры 300°С контактную разность потенциалов р-п перехода, сформированного в кремнии, если равновесные концентрации основных носителей заряда в р-n-областях одинаковы и равны 10 17см-3, а собственная концентрация ni = 1013см-3 .
Решение:
Vk = (KT/e)ln(nn/ np)
Учитывая, что
nn ·pp = ni2
Vk = (KT/e)ln(nn ·pp / ni2)
Величину ni определяем по формуле
ni = 2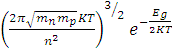
Значения nn и pp определим, исходя из выражений для удельной проводимости:
σn-Si = σnn + σpn = e(nnUn + pnUp)=e[nnUn+(ni2/nn) Up]
σp-Si = σpp + σpp = e(npUp + ppUn)=e[npUp+(ni2/pp) Un]
Отсюда
nn = σn-Si/2e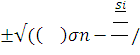 2e)2- ni2 Un Up
2e)2- ni2 Un Up
pp = σp-Si/2e![]() 2e)2- ni2 Un Up
2e)2- ni2 Un Up
Подставляя численные значения, получим:
ni2= 0,98 ·1018 м -3;
nn = 0,87 ·1023 м -1;
pp = 0,87 ·1021 м -1;
Vk = 0,395 В.
4. Задача 2
Определить положение узла, направления, плоскости в кристалле Si, индексы Миллера которых [[1 0 1]], [1/2 1 1], (121).
Найти температуру истощения примеси Si n-типа, если красная граница фотопроводимости составляет 6·10-6м. Постоянная Холла при этой температуре 4·10-3м-3/К. Рассеяние носителей заряда осуществляется на ионизированных примесях, mn=0,7m0.
Положение любого узла решетки определяется заданием трех координат: х , у, z . Эти координаты можно выразить следующим образом: х=та, y=nb, z=pc где а, Ь, с -параметры решетки: т, п. р - целые числа. За единицу измерения длины обычно принимают параметры решетки. Тогда координаты узла будут просто числа т,п,р. Это и есть индексы Миллера узла. Учитывая вышесказанное, узел I имеет индексы 1 – [[1 0 1]], а узел 2-[1 1 0].
За направление в кристаллической решетке принимают прямую, проходящую через начало координат. Тогда индексы узла I кристаллической решетки, через который она проходит, однозначно определяют индексы направления. Поэтому направление I имеет индексы [0 1 1], а направление 2 – [1 1 0].
Индексы плоскости отыскивают следующим образом. Выражают отрезки A, В, С, которые плоскость отсекает на осях решетки, в осевых единицах. Находят величины, обратные этим отрезкам: 1/A, 1/В, 1/С. Полученные дроби приводят к общему знаменателю. Пусть таковым будет число D. Тогда числа h=D/A , K=D/B , l =D/C принимают за индексы плоскости. Плоскость, изображенная на рис. 5.1, отсекает по соответствующим осям отрезки А = 1, В=1/2,С =1. Тогда 1/А =1; 1/В = 2; 1/С =1, D =1; h=1; К = 2; l = 1.
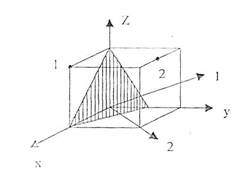
Рис. 5.1
Область истощения примеси. По мере повышения температуры концентрация электронов на примесных уровнях уменьшается — примесные уровни истощаются. При полном истощении этих уровней концентрация электронов в зоне проводимости будет равна концентрации примеси, если концентрацией собственных носителей можно по-прежнему пренебречь:
n = Nn (5.1)
Воспользовавшись для п выражением
n = Ne exp(μ/kT) (5.2)
получим
Ne exp(μ/kT)= Nд. (5.3)
Отсюда находим
μ = kTln(Nд /Nc). (5.4)
Уровень μ должен располагаться ниже уровней— Ед так как при μ = -Ед ионизации подвергается в среднем лишь половина примесных уровней. Однако обычно за температуру истощения примесей принимают температуру Та, при которой уровень Ферми совпадает с донорными уровнями Ед: μs = - Ед. Положив в формуле (5.2) Т = Тs, μ = μs и п = Nд/2, получим
μs = kTs ln(Nд /2Nc)= -Ед (5.5)
Отсюда находим температуру истощения примесей
Ts=![]() (5.6)
(5.6)
5. Задача 3
Определить, какие электрохимические процессы будут происходить на аноде и катоде. Найти толщину осажденной на катоде металлической пленки. Электролитом является водный раствор Ag2SO4. Сила тока I= 3 A. Время – 2 часа, площадь катода 5 см2 . Электроды платиновые.
Решение:
Распишем все возможные электрохимические реакции, которые могут протекать как на аноде так и па катоде; определим по таблице электродные потенциалы этих реакций.
В растворе находятся следующие ионы: Ag+ , SO2-4, а также нейтральные молекулы воды. Следовательно, на катоде (отрицательно заряженный электрод) могут протекать следующие электрохимические реакции:
Ag+e<—>Ag φ=+0,799B,
2Н20+2е<—> Н2↑+2OH φ=-0,413В
на аноде (положительно заряженный электрод):
2SО-2 4 -2е<—>S202- 8 φ=+2,01В,
2Н20-4е<—>02↑ +4Н* + φ = 0,81В.
Необходимо знать, что на аноде легче окисляются те атомы, молекулы, ионы, потенциалы которых в данных условиях наиболее низкие, а на катоде восстанавливаются легче те атомы, ионы, молекулы, потенциалы которых наиболее высокие. Сопоставление потенциалов показывает, что на катоде происходит восстановление серебра: Ag++е<—>Ag, а на аноде -окисление воды: 2Н2О - 4е<—>О2+4Н+ . Для определения толщины осажденной на катоде пленки серебра запишем объединенное уравнение законов Фарадея: m=(Э/F)lt,
где Э=A/Z
А - атомный вес,
Z - валентность;
F - постоянная Фарадея.
m=pV=psh,
где р - плотность серебра = 10,5 Г/см3;
s - площадь катода;
h - толщина пленки.
Отсюда h=AItr/FZps.
Подставляя численные значения, получим толщину осажденной на катоде пленки серебра.
h= 1,6·10-13 м.
Литература
1. Епифанов Е.И. , Мома Ю.А. "Физические основы конструирования и технологии РЭА и ЭВА" -М.Сов.радио, 1979г.-352с.
2. О.В. Митрофанов и др. "Физические основы функционирования изделий микроэлектроники". Серия "Микроэлектроника" М.Высшая школа 1987г.
3. Гусев В.Г., Гусев Ю.М. "Электроника" - М.Высшая школа 1991г.-622с.
4. Курс химии /Под ред. А.И.Харина - М. Высшая школа 1983г. - 542с.
5. Грушевский Б.С. "Основы электроники и микроэлектроники" Киев. Высшая школа, 1987г.- 384с.
6. Программа, методические указания и контрольные задания по курсу «Физические основы электронных устройств» / Сост. А.Н. Иванов - Северодонецк, СТИ, 2000 – 48 с.
Другие рефераты на тему «Физика и энергетика»:
- Уравнение состояния
- Эксплуатация дизельных электростанций
- Оценка технического состояния трансформаторных вводов на основе нечетких алгоритмов
- Ремонт внутрицеховых электросетей и источников освещения
- Правила устройства и безопасной эксплуатации сосудов, работающих под давлением, для объектов использования атомной энергии
Поиск рефератов
Последние рефераты раздела
- Автоматизированные поверочные установки для расходомеров и счетчиков жидкостей
- Энергосберегающая технология применения уранина в котельных
- Проливная установка заводской метрологической лаборатории
- Источники радиации
- Исследование особенностей граничного трения ротационным вискозиметром
- Исследование вольт-фарадных характеристик многослойных структур на кремниевой подложке
- Емкость резкого p-n перехода
