Разнообразие систем, формируемых дифильными веществами

2. KKM неионных ПАВ существенно ниже KKM ионных ПАВ. Соотношение этих величин зависит от длины алкильной цепи, но приблизительно разница составляет два порядка.
3. По сравнению с указанным выше основным различием ионных и неионных ПАВ влияние на KKM природы полярных групп не столь значительно. KKM катионных ПАВ всегда не
сколько больше, чем анионных. В случае неионных ПАВ при варьировании числа оксиэтиленовых групп наблюдается небольшое увеличение KKM при увеличении размера полярной группы.
4. Величина KKM сильно зависит от природы противоиона. Простые однозарядные неорганические противоионы не влияют на ККМ. Двухзарядные противоионы уменьшают KKM приблизительно в 4 раза. Органические противоионы снижают KKM так же, как неорганические противоионы, и тем больше, чем больше неполярная часть противоиона.
5. В случае разветвленных алкильных цепей, а также при наличии двойных связей, ароматических групп или при любом другом увеличении полярности гидрофобной части молекул наблюдается ощутимое изменение ККМ. Особенно сильное снижение KKM наблюдается при перфорировании алкильных цепей. Частичное фторирование неполярных цепей ПАВ может приводить к увеличению ККМ, например при фторировании концевой метальной группы величина KKM удваивается. Аномальное поведение частично фторированных ПАВ объясняется энергетически невыгодным взаимодействием углеводородных и фторуглеродных групп.
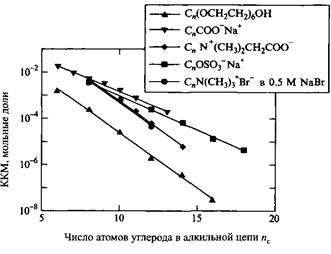
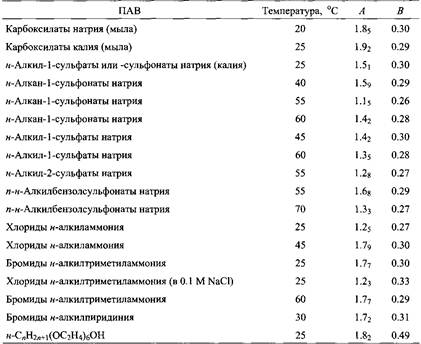
Таблица 2.4. KKM сильно уменьшается при увеличении длины алкильных цепей ПАВ. При этом выполняется следующее соотношение: Ig =A- Bnci где пс — число атомов углерода в алкильной цепи
Зависимость Ig KKM от числа атомов углерода в алкильной цепи ПАВ имеет линейный характер. Для неионных ПАВ, а также для ионных ПАВ в присутствии соли наклон прямых больше, нежели для ионных ПАВ без добавок электролита
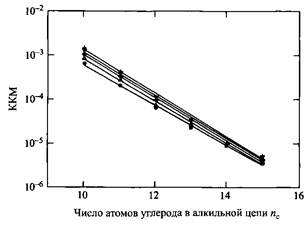
Зависимость Ig KKM от числа атомов углерода в алкильной цепи октамоноалкилэфиров при различных температурах
2. Влияние температуры и растворенных веществ на KKM
В первом приближении можно считать, что KKM мало зависит от температуры. В качестве подтверждения на рис. 2.6 представлена температурная зависимость KKM додецилсульфата натрия. KKM изменяется немонотонно приблизительно на 10-20% в широком диапазоне температур. Неглубокий минимум вблизи 25°С сопоставим с аналогичным минимумом растворимости углеводородов в воде. Неионные оксиэтилированные ПАВ ведут себя по-другому. Обычно они обнаруживают монотонное, гораздо более сильное снижение KKM с увеличением температуры. Зависимость свойств НПАВ от температуры вообще отличается от аналогичных зависимостей, установленных для ПАВ других классов. Давление мало влияет на KKM вплоть до очень высоких значений.
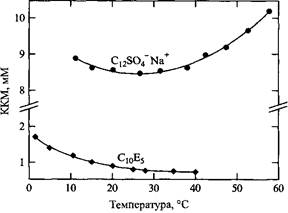
Температурная зависимость KKM додецилсульфата натрия и пентамонодецилового эфира
Влияние растворенных веществ на KKM — это важная и обширная тема, к которой мы будем неоднократно возвращаться. Наиболее важный вопрос относится к влиянию добавок электролитов на KKM ионных ПАВ. На рис. представлены данные для простейшего, но очень важного случая введения инертного электролита в раствор одновалентного ПАВ.

Влияние добавок хлорида натрия на KKM алкилсульфатов натрия. Сплошные линии — предсказания электростатической теории, cs – концентрация соли
При этом наблюдаются следующие закономерности.
1. Введение соли приводит к сильному понижению ККМ, которое может составлять порядок величины.
2. Эффект умеренный для короткоцепочечных ПАВ и намного сильнее для длинноцепочечных ПАВ.
3. Как следствие, при высоких концентрациях соли изменение KKM с ростом числа атомов углерода в цепи проявляется сильнее, чем в отсутствие электролита. Скорость изменения KKM при высоких концентрациях соли становится подобна скорости изменения KKM для НПАВ.
4. Влияние солей можно количественно оценить с помощью простой модели электростатических взаимодействий, т. е. на основании уравнения Пуассона-Больцмана.
5. Влияние добавленной соли на величину KKM сильно зависит от величины зарядов ионов. Наиболее сильно KKM зависит от заряда вводимого противоиона.
6. Простые соли оказывают слабое влияние на KKM НПАВ; возможно незначительное уменьшение или увеличение значений ККМ.
Другие низкомолекулярные растворенные вещества вызывают изменение KKM в разной степени в зависимости от их полярности. При этом возможно как увеличение, так и уменьшение ККМ. Незначительное или умеренное повышение KKM может наблюдаться при добавлении веществ, очень хорошо растворимых в воде. Причина в том, что вода является наиболее подходящим растворителем для самоассоциации ПАВ. Более частым и интересным случаем является понижение ККМ, наблюдаемое при добавлении ряда водорастворимых незаряженных веществ. Степень понижения KKM зависит от полярности растворенного вещества, что можно убедительно показать на примере простых спиртов. Спирты менее полярны, чем вода и распределяются между объемом раствора и мицеллами. Причем чем выше сродство спирта к мицеллам, тем больше молекулы спирта их стабилизируют. С увеличением длины алкильной цепи возрастает невыгодность растворения в воде и выгодность локализации молекул спирта в мицеллах. Таким же образом действуют любые другие неионные дифильные вещества, в том числе НПАВ, приводя к понижению ККМ.
2.1 Зависимость растворимости ПАВ от температуры
Известно много важных и весьма интригующих проявлений влияния температуры на самоассоциацию ПАВ. Одно из них, имеющее огромное практическое значение, — сильная температурная зависимость растворимости ПАВ, в основном характерная для ионных ПАВ. Их растворимость при низких температурах может быть очень незначительной, но резко увеличивается в относительно узком температурном интервале. Эту закономерность обычно называют явлением Крафта, а температуру начала резкого возрастания растворимости — точкой Крафта или температурой Крафта. Температурная зависимость растворимости ПАВ в этой области показана на рис.
Добавление простых спиртов приводит к понижению KKM, причем понижение KKM практически линейно зависит от концентрации спирта. Наклон зависимостей резко увеличивается с уменьшением полярности спирта.
Точка Крафта может сильно изменяться при незначительных вариациях в строении молекулы ПАВ. Для ПАВ с алкильными цепями характерны следующие закономерности.

1. Точка Крафта возрастает с увеличением длины алкильной цепи, причем возрастание не регулярное, проявляется различие между «хвостами» с четным и нечетным числом атомов С.
2. Точка Крафта сильно зависит от природы полярной группы и противоиона. Добавление солей обычно приводит к повышению точки Крафта. В то же время многие другие растворенные вещества ее понижают. Общие закономерности, связывающие точку Крафта и природу противоиона, не установлены. Например, точка Крафта щелочных алканоатов увеличивается при уменьшении атомного номера противоиона, тогда как для щелочных сульфатов или сульфонатов наблюдается прямо противоположная зависимость. В случае катионных ПАВ точка Крафта обычно выше для бромидов, чем для хлоридов, и еще выше для иодидов. В случае двухзарядных противоинов точка Крафта обычно заметно повышается.
Другие рефераты на тему «Химия»:
- Тест-системы для химического анализа
- Получение хлора и щелочи путем электролиза водных растворов хлоридов щелочных металлов. Извлечение ртути
- Разработка энергосберегающих технологий процесса ректификации продуктов синтеза хлорбензола
- Основные принципы подбора условий разделения
- Определение урана и тория в твердых материалах
