Электрокинетический потенциал и методы его определения
Это уравнение носит название уравнения Гельмгольца – Смолуховского для электроосмоса.
Таким образом, движение ионов диффузного слоя под действием электрического поля увлекает вследствие внутреннего трения всю массу жидкости, которая заполняет капилляры или поры, со скоростью Q в направлении поля.
Весьма существенно, что уравнение (5) не включает геометрических параметров системы (l, A);
все величины, входящие в правую часть уравнения, измеримы на опыте. Зависимость Q от I, изученная экспериментально для многих систем, оказалась линейной, подтверждая уравнение (5).
Таким образом, экспериментальное определение Q и I позволяет вычислить ζ-потенциал.
Рис. 2. Прибор для измерения электроосмоса в мембранах.
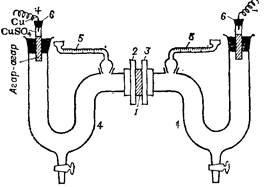
Для измерений применяют установки различного типа; пример одной из них приведен на рис. 2. Пористая мембрана 1, зажатая между фланцами 2 и 3, разделяет два симметричных сосуда 4 с отсчетными капиллярными трубками 5 и неполяризующими электродами (Сu/CuSO4 – агар) 6. Ячейку заполняют раствором электролита так, чтобы мениски жидкости находились в средней части градуированных трубок. Соединяя электроды с внешним источником тока, измеряют объем V жидкости, перемещающийся за время t в капиллярных трубках вследствие электроосмоса в мембране 1. Для расчетов используют среднее значение скорости Qср = (V + V’)2t, нивелируя таким образом изменения V, связанные с тепловым расширением. Измерения повторяют несколько раз, меняя направление тока. Значение I среднее за период измерения определяют по амперметру, а значения η, ε и к берут из таблиц. При выполнении измерений необходимо, чтобы уровни жидкости находились на одной высоте; это исключает влияние гидростатического давления.
Можно проводить опыт по-иному, предоставив жидкости подниматься в одном из колен сосуда. В этом случае установится равновесие, в котором электрическая сила равна гидростатической (весу столба жидкости). Используя выражения (3) и (4) и формулу Пуазейля:
![]() ,
,
где Q – расход жидкости (поток) в единицу времени; Р – дпаление; r и l- радиус и длина капилляра; К – константа, определяемая геометрическими параметрами, получаем:
![]()
Измеряя равновесную высоту поднятия h, и, следовательно, гидростатическое давление P = gdh, можно найти ζ, если известен радиус пор r.
Электрофорез
Движение частиц дисперсной фазы в постоянном электрическом поле в жидкой среде схематически изображено на рис. 3.

Рис. 3. Схема электрофореза
Отрицательно заряженная частица вместе с плотным слоем ионов внешней обкладки приобретает направленное движение в сторону положительного полюса, тогда как ионная атмосфера (диффузный слой) перемещается в противоположном направлении. При выборе системы координат, неподвижно связанной с частицей, получается картина, принципиально идентичная электроосмосу, и, следовательно, уравнение (3) должно быть применимым к электрофорезу (с обратным знаком). В отличие от электроосмоса здесь можно непосредственно измерить линейную скорость движения частиц u, а также поле X = E/l, гдн E – разность потенциалов на электродах; l – расстояние между ними.
Многочисленные эксперименты подтвердили применимость уравнения (3) к электрофорезу, в частности, линейную зависимость –uэф = -uэо от Х. Целесообразно ввести понятие электрофоретической подвижности v, равной скорости движения частицы в единичном поле (Х = 1):
|
|
![]()
|
![]()
где v выражено в ![]() =
= ![]() .
.
Значения v, измеренные на опыте, оказываются несколько меньшими, чем для обычных ионов в растворе и лежат в большинстве случаев в интервале (0,1 – 5)*10-4 см2/(с*В), что соответствует значениям ζ от 1,5 до 75 мВ.
Методика измерения электрофореза сводится либо к непостредственной регистрации скорости движения частицы в электрическом поле в плоской камере под микроскопом (или ультрамикроскопом) при помощи сетки или шкалы, помещенной в окуляр (окулярмикрометр), либо по скорости перемещения границы золя с «боковой» жидкостью в градуированной U-образной трубке.
Заключение
ζ-потенциал есть мера интенсивности элетрокинетических явлений.
Измеряя параметры таких электрокинетических явлений, как электроосмос и электрофорез, можно вычислить ζ-потенциал на основе теории, связывающей его с этими параметрами.
Экспериментальное определение Q и I позволяет вычислить ζ-потенциал.
Литература:
1) Фридрихсберг Д.А. Курс коллоидной химии. Л.: «Химия», 1980г.
2) Воюцкий С.С. Курс коллоидной химии. М.: «Химия», 1976г
3) Григоров О.Н. Электрокинетические явления. М.: «Наука», 1973г.
Другие рефераты на тему «Физика и энергетика»:
Поиск рефератов
Последние рефераты раздела
- Автоматизированные поверочные установки для расходомеров и счетчиков жидкостей
- Энергосберегающая технология применения уранина в котельных
- Проливная установка заводской метрологической лаборатории
- Источники радиации
- Исследование особенностей граничного трения ротационным вискозиметром
- Исследование вольт-фарадных характеристик многослойных структур на кремниевой подложке
- Емкость резкого p-n перехода
