Сульфат кальция, кристаллогидрат и безводная соль
Также сульфат кальция применяется для изготовления теплоизоляционных материалов (в смеси с асбестом). [6]
Глава 2. Экспериментальная часть
2.1 Способы получения CaSO4
2.1.1 Первый способ
Дигидрат CaSO4 2 H2O можно получить следующим образом:
Профильтрованный 20%
раствор CaCl2 осаждают 20% раствором H2SO4, взятой в избытке. После отстаивания сульфата кальция жидкость декантируют или сливают сифоном. Осадок несколько раз промывают декантацией до слабой реакции на ион хлора. Осадок два раза промывают этанолом на воронке Бюхнера и высушивают при 25 – 30˚С до исчезновения запаха спирта. При нагревании дигидрата до 150 - 170˚С он переходит в CaSO4 0,5 H2O. Обезвоживать сульфат кальция можно в фарфоровой чашке или на металлическом противне. Окончание обезвоживания можно контролировать по уменьшению массы исходного вещества. [7]
2.1.2 Второй способ
В отфильтрованный тёплый раствор 20 г (NH4)2SO4 в 250 мл воды приливают раствор 50 г CaCl2 в 200 мл воды и проверяют полноту осаждения (в отфильтрованном растворе при добавлении CaCl2 не должно образовываться осадка). После отстаивания осадок промывают 5 – 6 раз декантацией, отсасывают на воронке Бюхнера и промывают до полного отсутствия ионов NH4+ в промывных водах (проба реактивом Несслера (K2[HgI4] в 2н КОН)). Препарат сушат на пергаментной бумаге при 60-70˚C. Выход составляет 20-22 г (80-85%). Полученный препарат соответствует реактиву квалификации ч. [8]
2.1.3 Получение безводного сульфата кальция
Безводный сульфат кальция получают нагреванием при 225±5˚С двух- или полуводного CaSO4. Температура, при которой высушивают сульфат кальция, имеет большое значение для препарата, который пригоден для быстрого поглощения паров воды (если CaSO4 будет использован в качестве осушителя). Никоем случае нельзя допускать нагревание выше указанной температуры.
Перед высушиванием CaSO4 2 H2O или CaSO4 0,5 H2O измельчают и просеивают через сито (имеющее ячейки 1-2 мм). Отсеянные зёрна (а не мелочь, прошедшую через сито) помещают в хлоркальциевые трубки, чаще U-образной формы, которые нагревают 2-3 часа при 225±5˚С с протягиванием через них воздуха, предварительно высушенного над Р2О5. Скорость протягивания воздуха ≈ 50 мл/мин. Использованный в качестве осушителя CaSO4 можно много раз регенерировать, он нейтрален, химически инертен и при насыщении водой не расплывается. [5]
2.2 Расчёт исходных веществ для синтеза
В работе был использован синтез из п. 2. 1. 1.
CaCl2∙2H2O + H2SO4 = CaSO4 2H2O + 2 HCl
Чтобы получить ≈ 6 г CaSO4 2 H2O :
n(CaSO4 2 H2O) = ![]() = 0,034 моль;
= 0,034 моль;
n(CaCl2∙2H2O) = 0,034 моль;
m(CaCl2∙2H2O) = 0,034 моль * 147 г/моль = 5 г;
mр-ра(CaCl2∙2H2O) = ![]() = 25 г;
= 25 г;
m(H2O) = V(H2O) = 20 мл;
n(H2SO4 ) = 0.034 моль;
m(H2SO4 ) = 0,034 моль * 98 г/моль = 3,3 г;
mр-ра(H2SO4 ) = ![]() = 16,5 г;
= 16,5 г;
Vр-ра(H2SO4) =  = 14,5 мл;
= 14,5 мл;
Так как кислоту нужно взять в избытке, то для реакции возьмём 20 мл 20% раствора H2SO4 .
Из кислоты, имеющейся в лаборатории (92% раствор с ρ = 1,83 г/мл) надо получить 20 мл 20% раствора H2SO4 (ρ = 1,14 г/мл):
mр-ра(20% H2SO4 ) = 1,14 г/мл * 20 мл = 22,8 г;
mв-ва(20% H2SO4 ) = ![]() = 4,56 г;
= 4,56 г;
mр-ра(92% H2SO4 ) = ![]() = 4,95 г;
= 4,95 г;
Vр-ра(92% H2SO4) = 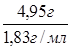 = 2,6 мл;
= 2,6 мл;
V(H2O) = 17,4 мл.
Таким образом, для синтеза возьмём 5 г CaCl2 , растворённого в 20 мл воды и 2,6 мл 92% раствора H2SO4 , растворённого в 17,4 мл воды.
H2SO4 ,
2.3 Оборудование, посуда и реактивы для синтеза
Для получения CaSO4 взяли:
5 г CaCl2 , растворённого в 20 мл воды,
20 мл 20% раствора H2SO4 .
Для проведения качественного анализа на ионы:
AgNO3 , BaCl2 , щавелевая кислота.
Для промывания:
этанол, дистиллированная вода.
Посуда, приборы, материалы:
мерный цилиндр,
пипетка,
химический стакан,
фарфоровая чашка,
воронка,
пробирки,
стеклянная палочка,
колба Бунзена,
воронка Бюхнера,
водоструйный насос,
плитка,
весы,
фильтровальная бумага.
2.4 Техника безопасности
· При работе с концентрированной серной кислотой следует быть осторожными; все работы с ней проводить под тягой;
· При разбавлении концентрированной серной кислоты следует наливать кислоту в воду;
· Так как при разбавлении серной кислоты происходит выделение тепла, не следует держать в руках сосуд, в котором готовится раствор;
· При проливе кислоты на пол надо засыпать её песком, затем мокрый песок удалить, и остатки кислоты смыть водой;
· При попадании кислоты на кожу следует промыть обожжённое место 2-3% раствором соды;
· При попадании реактивов в глаза нужно промыть их водой и обратиться к врачу;
· При работе со стеклянной посудой и приборами следует соблюдать осторожность.
Глава 3. Результаты эксперимента и их обсуждение
3.1 Выполнение эксперимента
Отвесили на электронных весах 5 г CaCl2 , растворили его в 20 мл воды, отфильтровали раствор. Отмерили пипеткой 2,6 мл 92% раствора H2SO4 и влили его в 17,4 мл воды, соблюдая при этом правила техники безопасности. Раствор CaCl2 осадили раствором H2SO4 , взятой в избытке. После отстаивания жидкость слили, а осадок продекантировали дистиллированной водой до слабой реакции на ион хлора, наличие которого проверяли раствором AgNO3. Затем осадок перенесли на воронку Бюхнера и промыли водой до исчезновения реакции на ион хлора (отсутствие белого осадка AgCl). Промыли осадок этанолом, отжали между двумя листами фильтровальной бумаги и высушили при комнатной температуре до постоянной массы. Взвесили полученное вещество:
mтеор = 6 г;
mпракт = 4,2 г;
η = ![]() ∙100% = 70%
∙100% = 70%
Потери продукта могли произойти в процессе промывания осадка, декантации. При переносе осадка из стакана на фильтр небольшая часть сульфата кальция могла остаться на стенках стакана, что повлияло на выход продукта.
3.2 Качественные реакции
Провели качественные реакции на наличие ионов Ca2+ и SO42-
На сульфат-ион:
Качественной реакцией на сульфат-ион является катион бария Ba2+. Хлорид бария с анионом SO42- образует белый осадок BaSO4 , не растворимый в кислотах.
