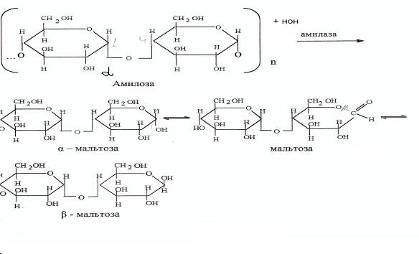
Специфичность фермента амилазы
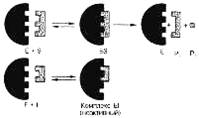
Рис. 1 Действие конкурентного ингибитора (схема по В.Л. Кретовичу). Е - фермент; S - субстрат; Р1 и Р2 - продукты реакции; I - ингибитор.
Благодаря этому структурному сходству сульфаниламид блокирует действие фермента путем вытеснения парааминобензойной кислоты из комплекса с ферментом, синтезирующим фолиевую к
ислоту, что ведет к торможению роста бактерий.

Некоторые аналоги витамина В6 и фолиевой кислоты, в частности дезоксипиридоксин и аминоптерин, действуют как конкурентные, так называемые коферментные, ингибиторы (или антивитамины), тормозящие многие интенсивно протекающие при патологии биологические процессы в организме. Применение подобных аналогов в медицинской практике (в частности, в дерматологии и онкологии) основано на конкурентном вытеснении коферментов из субстрат связывающих центров ключевых ферментов обмена.
Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым. Примером необратимого ингибирования является действие йодацетата, ДФФ, а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это действие заключается в связывании и выключении функциональных групп или ионов металлов и молекуле фермента.
Следует указать, что неконкурентное ингибирование также может быть обратимым и необратимым, поскольку отсутствует конкуренция между субстратом и ингибитором за активный центр. Примеры необратимого ингибирования приведены ранее. При обратимом неконкурентном ингибировании субстрат S и ингибитор I связываются с разными центрами, поэтому появляется возможность образования как комплекса EI, так и тройного комплекса EIS; последний может распадаться с освобождением продукта, но с меньшей скоростью, чем комплекс ES.

Этот тип неконкурентного ингибирования чаще всего наблюдается у ферментов, катализирующих превращения более одного субстрата, когда связывание ингибитора не блокирует связывание субстрата с активным центром. Ингибитор при этом соединяется как со свободным ферментом, так и с ES-комплексом.
Известно, кроме того, так называемое бесконкурентное ингибирование, когда ингибитор связывается с ферментом также в некаталитическом центре, однако не со свободным ферментом, а только с ES-комплексом в виде тройного комплекса.
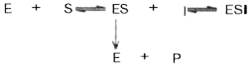
Для выяснения вопроса о типе ингибирования пользуются уравнениями Михаэлиса-Ментен, Лайнуивера-Бэрка или другими, например уравнением Эди-Хофсти:
ν = -Km(y/[S]) + Vmax
и соответствующими графиками в прямолинейных координатах.
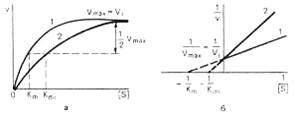
Рис. 2. Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора.
а - в координатах v от [ S ] ; б - в координатах 1/v от 1 / [ S ] ; Vmaxи Vi - максимальные скорости реакции; Кm и Kmi - константа Михаэлиса соответственно в отсутствие (1) и в присутствии (2) ингибитора.
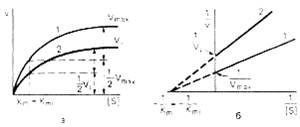
Рис. 3. Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора.
При конкурентном типе ингибирования ингибитор увеличивает значение Кm, не оказывая влияния на максимальную скорость Vmax. Это означает, что при достаточно высокой концентрации субстрата [ S ] ингибитор вытесняется молекулами субстрата из комплекса EI. При неконкурентном ингибировании (рис. 4.22) ингибитор снижает величину максимальной скорости. Если при этом величина Кm не уменьшается, то говорят о полностью неконкурентном ингибировании. Подобный тип ингибирования имеет место при образовании неактивных, труднодиссоциирующих комплексов EI и (или) EIS. Часто, однако, наблюдается смешанный тип ингибирования, иногда называемый частично неконкурентным, или обратимым неконкурентным ингибированием (см. ранее), при котором снижение Vmax сочетается с одновременным увеличением значений Кm. Это означает, что комплекс EI сохраняет частичную активность, т.е. способность к образованию промежуточного тройного комплекса EIS, в котором субстрат подвергается замедленному каталитическому превращению. В редких случаях степень торможения активности фермента может увеличиваться с повышением концентрации субстрата. Для этого типа торможения был предложен, как отмечено ранее, довольно неточный термин «бесконкурентное ингибирование». Один из механизмов такого торможения обусловлен возможностью соединения ингибитора с комплексом ES с образованием неактивного или медленно реагирующего тройного комплекса EIS.
2. ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ
Исследование воздействия внешних факторов на амилазу слюны1. Специфичность амилазы слюныМетодика приготовления разбавленной слюны:Прополоскать рот два раза дистиллированной водой для удаления остатков пищи. Взять в рот 20 мл. дистиллированной воды, держать её во рту около двух минут. полученную жидкость слить в стакан или колбу. Жидкость представляет собой раствор слюны, содержащий амилазу-фермент.Ход работы:В 2 пробирки добавить по 20 капель раствора крахмала, в 3-ю- 20 капель раствора сахарозы.В первую пробирку налить 10 капель дистиллированной воды, во вторую и в третью пробирки добавить по 10 капель разведенной слюны. Содержимое пробирок перемешать встряхиванием и поместить пробирки в водяную баню с температурой 37-40’ С. Через пять минут пробы разделить пополам и проделать реакции с йодом (для чего добавить в каждую пробирку по 1 капле раствора йода в йодистом калии) и с фелинговой жидкостью (добавить по 5 капель фелинговой жидкости).Результаты отражены в таблице 1 Таблица 1
| № пробирки | Субстрат | фермент | Реакция с йодом | Реакция с Фелинговой жидкостью | |
| До | После | ||||
| 1 | крахмал | бесцветный. | Сине-фиолетовое окрашивание (со временем исчезает) | - | |
| 2 | крахмал | амилаза | Бесцветный | - | |
| 3 | сахароза | амилаза | бесцветный | Голубой оттенок (со временем не исчезает) | - |