Синтез хлороформа. Реакции нуклеофильного замещения и элиминирования галогеналканов

Поскольку углерод имеет больший атомный номер, чем водород, то С2Н5 старше. Таким образом, во втор-бутилхлориде заместители, согласно своему старшинству, располагаются следующим образом: С1 >С2Н5>СН3 > Н.
В З-хлор-2-метилпентане атомы С, С и Н изопропильной группы старше С, Н и Н этильной группы и полная последо
вательность заместителей будет следующей: С1 > изопропил > этил > Н.
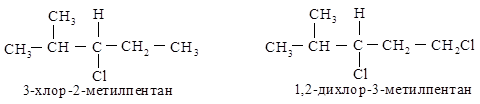
В 1,2-дихлор-З-метилпентане группа СН2Cl старше (С1, Н, Н) изопропильной (С, С, Н). Хлор имеет больший атомный номер, чем углерод, и то, что имеется два атома углерода и только один С1, не имеет значения. (один больший номер значит больше, чем два или три меньших.)
Правило старшинства 3. Атом, связанный двойной или тройной связью, считается соответственно за два или три атома. Таким образом,

Например, в глицериновом альдегиде ОН-группа является старшей; СНО (О, О, Н) старше СН2ОН (О, Н, Н). Полная последовательность заместителей будет –ОН > –СНО > –СНаОН > –Н.
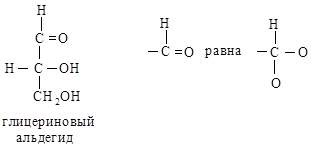
Фенильная группа С6Н5 рассматривается в виде одной из структур Кекуле:

В 1-амино-2-метил-1-фенилпропане, например, фенильная группа (С, С, С) старше изопропильной (С, С, Н), но младше, чем N, который имеет больший атомный номер. Последовательность будет NН2 > С6Н5 > С3Н7 > Н.
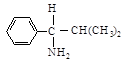
Обозначение конфигурации соединений с несколькими асимметрическими атомами: Существуют соединения с несколькими асимметрическими атомами Вопрос об их обозначении не представляет проблемы: обозначают конфигурацию каждого асимметрического атома углерода и, используя нумерацию, указывают, к какому атому относится каждое обозначение.
Рассмотрим, например, 2,3-дихлорпентаны. Каждый асимметрический атом углерода, С-2 и С-3, рассматривается по порядку без учета существования другого центра. Согласно правилам старшинства для С-2 получают последовательность С1 > СН3СН2СНСl > СНз > Н, а для С-3 — С1 > СН3СНС1> СН3СН2 > Н. (Почему СН3СНСl —«старше», чем СН3СН2—?)
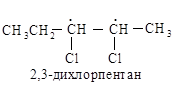
При рассмотрении модели определенного стереоизомера сначала концентрируют внимание на С-2 (игнорируя С-3), а затем на С-3 (игнорируя С-2). Стереоизомер I обозначают как (2S, 3S)-2,3-дихлорпентан, а другие изомеры — как (2R, ЗR), (2S, ЗR) и (2R, 3S).
Рассмотрим таким же образом 2,3-дихлорбутан. В этом случае два асимметрических aтома углерода эквивалентны, и нет необходимости их нумеровать.

Например, в случае СНСlВгI с асимметрическим атомом углерода связаны четыре различных атома, и старшинство их зависит только от атомного номера, причем, чем больше атомный номер, тем старше заместитель. Таким образом, в порядке уменьшения их старшинства атомы располагаются в следующем порядке: I > Вг > С1 > Н.
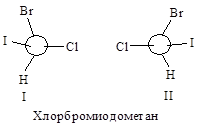
Затем молекулу располагают, так, чтобы младшая группа была направлена от наблюдателя, и рассматривают расположение оставшихся групп. Если старшинство этих групп уменьшается по часовой стрелке, то конфигурацию обозначают символом R (от латинского rectus — правый); если же старшинство этих групп уменьшается против часовой стрелки, то конфигурацию обозначают символом S (от латинского sinister — левый).
Таким образом, конфигурации I и II выглядят следующим образом:

и обозначаются соответственно символами R и S.
Полное название оптически активного соединения отражает и конфигурацию и направление вращения, как, например, (S)-(+)-втор-бутилхлорид. Рацемическую модификацию можно обозначить символом R,S, например (R,S)-втор-бутилхлорид.
Конечно, нельзя путать направление оптического вращения соединения (такого же физического свойства реального вещества, как температура кипения или плавления) с направлением нашего взгляда, когда мы мысленно располагаем молекулу каким-то определенным условным образом. Пока для определенного соединения экспериментально не установлена связь между конфигурацией и знаком вращения, нельзя сказать, знак (+) или (–) соответствует (R)- или (S)-конфигурации.
Сила нуклеофила. Нуклеофил - частица, имеющая пару электронов, которую она может отдать атому углерода, несущему целый или частичный положительный заряд. Чем сильнее атом удерживает пару электронов, тем меньше его способность выступать в качестве нуклеофила.
Активность аниона выше, чем активность нейтральной молекулы.
![]()
Нуклеофильный реагент, предоставляющий пару электронов электронодефицитному атому углерода, способен подавать эту пару атому водорода и отщеплять его, превращаясь в кислоту, т.е. каждый нуклеофильный реагент является основанием. Нуклеофильная реакционная способность и основность изменяются параллельно у реагентов, в которых пара электронов находится на одном и том же атоме или неподеленная пара электронов находится у атомов элементов, принадлежащих одному периоду.
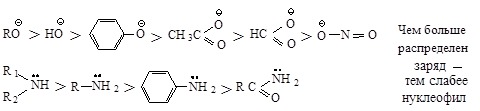
![]()
Реакционная способность нуклеофилов с атомами, находящимися в одной группе, зависит от положения элемента в этой группе: чем больше электроотрицательность атакующего атома, тем более реакционноспособен нуклеофил.
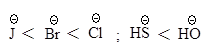
В протонных растворителях нуклеофильность аниона тем выше, чем больше размер иона.
![]()
Такой порядок изменения нуклеофильности в протонном растворителе объясняется тем, что анионы разного размера в протонном растворителе в различной степени сольватированы за счет образования водородных связей: анион малого размера с концентрированным зарядом сольватируется сильнее и стабилизирован в большей степени, чем анион большего размера, в котором отрицательный заряд распределен в большей степени.
Сила нуклеофила играет важную роль: например, неопентилбромид реагирует с этилат-ионом по SN2-механизму, а с этиловым спиртом – по SN1 -механизму. Сильный нуклеофил (сильное основание), этилат-ион, выталкивает ион галогена из молекулы, тогда как слабый нуклеофил, этиловый спирт, ждет, пока ион галогена отойдет.
Реакционная способность. При рассмотрении реакционной способности галогеналканов в реакциях нуклеофильного замещения следует изучать влияние двух факторов: пространственного (стерического) и электронного. В случае бимолекулярного нуклеофильного замещения наиболее важную роль играет стерический фактор. По мере увеличения числа и объема заместителей у атома углерода - реакционного центра возможность достижения активированного комплекса уменьшается. Это могут быть как алифатические, так и ароматические заместители или те и другие.
