Синтез хлороформа. Реакции нуклеофильного замещения и элиминирования галогеналканов
Механизм Е2. Основание НО–атакует водород (рис.2.6.а) при Сb, подает ему пару электронов и начинает образовывать с ним связь, связь Сb-Н ослабевает, пара электронов, связывавшая углерод и водород, освобождается и атакует атом галогена с тыла., одновременно растягивается связь Сa -Br (процесс согласованный). Возникает активированный комплекс: атомы углерода Сa и Сb переходят из sp3-гибрид
ного состояния в состояние, близкое к sp2-состоянию, освобождающаяся пара электронов затрачивается на образование p-связи (рис.2.6.б) . Затем связи углерод- водород и углерод-галоген разрываются, атомы углерода переходят в sp2-состояние, образуется p-связь (рис.2.6.в).

Рис.2.6. Механизм реакции бимолекулярного элиминирования; а – антикомпланарное расположение связей Сa—Br и Сb—H, б – переходное состояние, в – конечные продукты.
Энергетическая диаграмма реакции изображена на следующем графике:
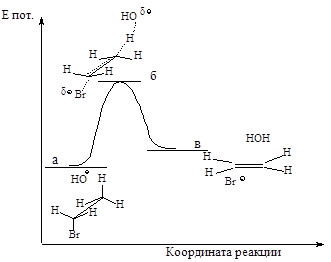
Рис.2.7. График изменения потенциальной энергии в ходе Е2.
Связи, разрывающиеся в активированном комплексе, должны быть в транс-положении друг к другу. Такая геометрия позволяет электронной паре, освобождающейся при связывании протона с основанием, атаковать с тыла атом углерода Сa и вытеснять галоген. Копланарность двух связей субстрата: Сa -Br и Сb -Н, которые разрываются в активированном комплексе, обеспечивает максимальное перекрывание р-орбиталей, то есть способствует процессу образования p-связи. Такая комбинация условий называется стереоэлектронным требованием.
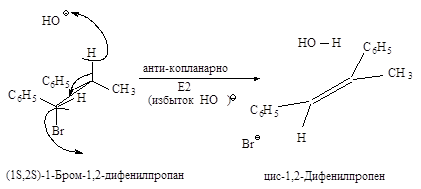
Ниже эта реакция изображена в проекциях Ньюмена.
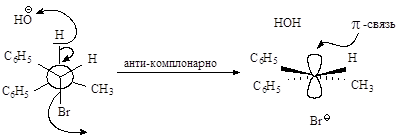

Реакция, в результате которой из данного стереоизомерного соединения получается в качестве продукта только один стереоизомер, называется стереоспецифической реакцией.
Cкорость реакции зависит от концентрации галогеналкана и основания и определяется по формуле V= K[R-Br][O–].
Направление элиминирования - правило Зайцева: основным продуктом реакции отщепления от галогеналканов с двумя не эквивалентными Сb является наиболее устойчивый (наиболее алкилированный) алкен.
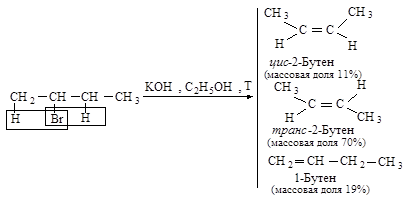
Основным продуктом реакции элиминирования 2-хлорбутана является транс-2-бутен (соотношение цис- и транс-изомеров 1:6). Активированный комплекс, возникающий при образовании транс-изомера, менее пространственно затруднен и более устойчив, и, следовательно, скорее образуется, чем активированный комплекс, ведущий к цис-изомеру.
Реакционная способность галогеналканов в реакциях Е2 изменяется в ряду:
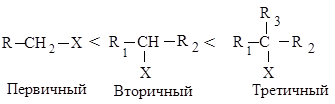
Такое увеличение реакционной способности галогеналканов при переходе от первичных к третичным обусловлено увеличением устойчивости образующихся алкенов.
2.2.2. Мономолекулярное отщепление Е1
Третичные галогеналканы реагируют по мономолекулярному механизму.
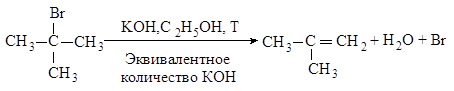
Механизм. Реакция протекает в две последовательные стадии. Первая стадия аналогична первой стадии мономолекулярного нуклеофильного замещения:

Во второй стадии основание атакует водород при Сb - атоме.
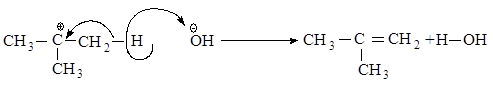
Реакционная способность галогеналканов увеличивается при переходе от первичных к третичным. Это обусловлено увеличением устойчивости карбокатионов, образующихся в медленной стадии.
2.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
В реакциях замещения донор электронной пары отдает свою пару электронов атому углерода Сa, связанному с галогеном - в этом случае он является нуклеофилом. Тот же донор электронов может отдавать свою электронную пару атому водорода, связанному с Сb - в этом случае он является основанием в реакциях элиминирования.
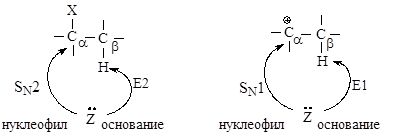
Реакции элиминирования и нуклеофильного замещения в этом случае являются конкурирующими. При переходе от первичных ко вторичным и далее третичным галогеналканам элиминирование происходит все в большей степени.

Cильные основания в большей степени способствуют элиминированию. Выход продуктов элиминирования увеличивается за счет продуктов замещения также с повышением температуры.
2.3. Методы синтеза галогеналканов
2.3.1. Галогенирование алканов
2.3.2. Присоединение галогенводородов к олефинам
2.3.3. Замещение гидроксильной группы спиртов на галоген
· действием галогенводородов:
![]()
или
![]()
· галогенидов фосфора:

· или хлористым тионилом:
![]()
Список литературы
1. Агрономов А.Е., Шабаров Ю.С. Лабораторные работы в органическом практикуме. Изд. 2-е, М., Химия, 1974, с. 83
2. Губен И. Методы органической химии. Том III, выпуск 3, М., ОНТИ, 1935,437
3. Кацнельсон М. М. Приготовление синтетических химико-фармацевти-ческих препаратов. Л., Госхимиздат, 1933,132.
4. Препаративная органическая химия. Изд. 2-е, М., Гохимиздат, 1964,188.
5. Швицер Ю. Производство химико-фармацевтических и технохимичес-ких препаратов. М.-Л., ОНТИ, 1934, 106.
6. Шабаров Ю.С. Органическая химия: В 2-х кн. - М.: Химия, 1994.- 848 с.
7. ПетровА.А., Бальян Х.В., Трощенко А.Т. Органическая химия. - М.: Высш. шк., 1973. - 623 с.
8. Моррисон Р., Бойд. Органическая химия. - М.: Мир, 1974. - 1132 с.
9. Терней А. Современная органическая химия: В 2 т. - М.: Мир, 1981. - Т.1 - 670 с; Т.2 - 615 с.
10. Робертс Дж., Кассерио М. Основы органической химии: В 2 т. - 2-е изд. -М.: Мир, 1978. - Т.1 - 842 с; Т.2 - 888 с.
11. Веселовская Т.К., Мачинская И.В., Пржиялговская Н.М. Вопросы и задачи по органической химии. - М.: Высш. шк., 1977. - 230 с.
12. В. Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, - 708 с.
