Экстракционно-фотометрический метод определения тяжелых металлов в природных водах
Следовательно, экстракционно-фотометрический метод позволяет определять содержание Сr+6 в поверхностных водах на уровне 1-30 ПДК и может быть использован при оперативном контроле, в том числе в условиях работы передвижной гидрохимической лаборатории. При этом методе можно проводить измерения в потоке воды, проба может последовательно проходить несколько различных кювет, где можно измерить други
е параметры, может использоваться установка на участке сброса вод, измерения могут проводится периодически, не нужен постоянный контроль, для определения концентрации хрома в воде впрыскивается избыточное количество экстракта, которое связывает почти 100% ионов хрома, что позволяет более точно провести измерения.[8-12]
Так как в качестве экстракта была выбрана суспензия, то прошедший через нее поток быстро затухает, и поэтому в качестве информативного параметра был выбран отраженный поток, который зависит от длины волны источника излучения и концентрации ионов хрома (рис. 1).
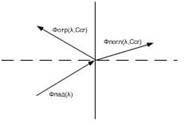
Рисунок 1 – Движение потока излучения
Так как источник излучения частотно зависим и спектр поглощения ограничен, то в качестве источника излучения выбирается светоизлучающий диод (СИД) с длиной волны l=540 нм, что соответствует максимуму спектра поглощения и обеспечивает избирательность метода. Функцию избирательности можно усилить введением дополнительно оптического фильтра на длине волны l=540 нм с полосой пропускания 25±10 нм.
Фотометр представляет собой прибор для канала измерительной автоматизированной системы контроля сточных вод (такие системы обслуживаются раз в 2 недели), в котором измеряется концентрация ионов хрома Сr+6. Также в данной системе могут быть каналы измерения других величин. Например, на измерение Сr+6 оказывает влияние уровень рН (учет данного фактора позволяет уменьшить погрешность с 6-7% до 3-4%). Для учета и оптимизации уровня рН при измерении концентрации ионов хрома Сr+6 целесообразно вводить в пробу необходимое (дозированное) количество кислоты Н2SO4. На измерение рН в свою очередь влияет температура. Поэтому уровень рН и температуры необходимо измерять. В результате имеем многоканальную систему, состоящую, как минимумом, из трех каналов измерения: рН, температуры и концентрации ионов хрома Сr+6.
Влияние рН на результаты фотометрического измерения.
При уменьшении кислотности среды, т. е. при повышении рН раствора, катионы металла, как правило, взаимодействуют с ОН-ионами, образуя в конечном счете малорастворимые гидроксиды или основные соли. Окрашенное соединение при этом разрушается. Малорастворимое соединение может и не образоваться, тем не менее участие определяемых катионов в сопряженном комплексообразовании с ОН-ионами значительно уменьшает условную константу устойчивости окрашенного комплекса и, следовательно, приводит к уменьшению степени связанности определяемого иона в окрашенное соединение. Особенно сильное влияние наблюдается для малопрочных комплексов, которые при увеличении рН раствора могут быть разрушены полностью.
Поэтому реакции образования окрашенных соединений ионов металлов с анионами сильных кислот целесообразно проводить в достаточно кислых средах, где условная константа устойчивости окрашенного комплекса сохраняет свое наибольшее значение.
Окрашенные комплексы с анионами слабых кислот. Когда в качестве реагентов используют слабые органические кислоты HR (салициловая кислота, ализарин, диметилглиоксим и др.), изменение рН раствора оказывает очень сильное, хотя внешне и не всегда заметное, влияние. Полнота связывания иона М в окрашенное соединение MRn зависит от концентрации в растворе анионов реагента R– которая в свою очередь зависит от концентрации Н+ в растворе. В кислых растворах концентрация R– бывает невелика, так как равновесие ионизации слабой кислоты HR сильно смещено в сторону недиссоциированной (кислотной) формы реагента. Увеличить концентрацию R– путем повышения общей концентрации реагента не всегда удается, поскольку слабые органические кислоты часто имеют ограниченную растворимость. В этом случае концентрацию увеличивают повышением рН раствора, которое смещает равновесие ионизации кислоты в сторону его солевой формы R– .
Таким образом, реакции образования окрашенных соединений ионов металлов с анионами слабых кислот следует проводить по возможности в менее кислых средах. Однако уменьшение концентрации Н+ необходимо осуществлять очень осторожно, так как при повышении рН раствора может происходить образование основных солей или гидроксидов определяемых металлов; может изменяться состав окрашенного соединения вследствие ступенчатости комплексообразования. В некоторых случаях, когда влияние конкурирующего комплексообразования ОН-ионов преобладает над влиянием депротонирования реагента, повышение рН раствора может привести к противоположным результатам, т. е. к уменьшению степени связанности иона М в окрашенное соединение. Поэтому максимальный выход светопоглощающего комплекса будет наблюдаться только в определенном интервале значений рН раствора.
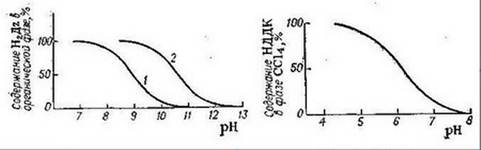
Рисунок 2 - Распределение дитизона в зависимости от рН водной фазы: 1 - CCl4; 2 - CHCl3
Диэтилдитиокарбаминовая кислота в кислых растворах разлагается на диэтиламин и сероуглерод, поэтому при хранении растворы Na-ДДК слегка подщелачивают (примерно до рН = 9). Распределение реагента между водной и органической фазами зависит от рН среды (рис. 2). При рН до 4 реагент в виде кислоты полностью переходит в органическую фазу, а. при рН выше 8 практически количественно остается в водном слое, что показано на рисунке 3:

Выяснение зависимости светопоглощения раствора от времени и температуры
Фотометрический анализ обычно проводят при одинаковой комнатной температуре, так как изменение температуры раствора во многих случаях вызывает соответствующее изменение светопоглощения. Если даже небольшое изменение температуры (на 2—3 °С) приводит к значительному изменению оптической плотности фотометрируемого раствора, то измерения последней производят после предварительного термостатирования.
Для выяснения устойчивости светопоглощения фотометрируемого соединения во времени измеряют оптическую плотность раствора через некоторые промежутки времени и строят график зависимости оптической плотности от времени. Для последующей работы выбирают такой интервал времени, в течение которого максимальное значение оптической плотности раствора сохраняется неизменным или меняется незначительно. Кроме того, на протяжении всех измерений строго выдерживают время между измерением оптической плотности и приготовлением фотометрируемого раствора.[12-14]
Связь концентрации ионов хрома Сr+6 с параметрами, влияющими на ее измерение можно представить в виде системы (1).

где Ссr – концентрация хрома;
Другие рефераты на тему «Экология и охрана природы»:
Поиск рефератов
Последние рефераты раздела
- Влияние Чекмагушевского молочного завода на загрязнение вод реки Чебекей
- Влияние антропогенного фактора на загрязнение реки Ляля
- Киотский протокол - как механизм регулирования глобальных экологических проблем на международном уровне
- Лицензирование природопользования, деятельности в области охраны окружающей среды и обеспечения экологической безопасности
- Мировые тенденции развития ядерной технологии
- Негативные изменения состояния водного бассейна крупного города под влиянием деятельности человека
- Общественная экологическая экспертиза и экологический контроль
