Кинетические методы определения загрязнителей в различных природных средах
В кинетических методах наиболее часто используют метод тангенсов как наиболее точный (использует большое число экспериментальных данных) и универсальный (применим для реакций с индукционным периодом). Реже применяют способ фиксированного времени и способ фиксированной концентрации, хотя эти способы более просты и менее трудоемки. Способ фиксированной концентрации используют обычно при автоматиз
ации контроля, способ фиксированного времени — при проведении серийных анализов.
Метод каталиметрического титрования применяют для определения с повышенной точностью микросодержания ионов металлов или органических соединений, образующих с ионом металла устойчивые, каталитически неактивные комплексы, и следов органических веществ в неорганических солях особой чистоты. При титровании органического соединения избыток титранта (иона металла-катализатора) уже в концентрации 10–8–10–6 М вызовет протекание каталитической реакции и тем самым определит конечную точку титрования .
Основное применение каталитических методов в анализе реактивов и веществ особой чистоты — определение микроконцентраций переходных металлов. Именно каталитические методы позволяют определить ионы элементов, содержание которых часто лимитируется в технических условиях на вещества особой чистоты табл. 1.
Чистота цитирования примесей* в веществах особой чистоты [16] и пределы обнаружения их каталиметрическими методами
|
Примесь |
Чистота цитирования, % |
Предел обнаружения, нг/мл |
Примесь |
Чистота цитирования, % |
Предел обнаружения**, нг/мл |
|
Fe |
100 |
1 |
Ag |
31 |
1 |
|
Cu |
96 |
1 |
Pb |
31 |
10 |
|
Ni |
66 |
1 |
Ti |
26 |
1 |
|
Mn |
76 |
0,1 |
V |
21 |
0,1 |
|
Co |
70 |
0,1 |
Mo |
8 |
1 |
|
Cr |
41 |
1 |
W |
7 |
5 |
Чаще всего лимитируется содержание железа и меди (допустимый уровень — 10–4–10–6%). Другие примеси определяют реже, но для некоторых веществ необходим контроль их содержания на уровне 10–7%, который не обеспечивается традиционными методами эмиссионной спектроскопии и спектрофотометрии. Особенно успешно каталитические методы применяются для определения Co, Mn, V, Mo, W, Nb, Ta. Кроме того, при анализе веществ особой чистоты каталитические методы позволяют определять отдельные анионы, органические соединения в неорганических солях, отклонения от стехиометрии в составе соединений.
Нижняя граница концентраций, определяемых с применением каталитических методов, для большинства элементов составляет 10–8–10–9 М (10–3–10–4 мкг/мл), т. е. на 1–2 порядка ниже, чем в методах спектрофотометрии, полярографии и пламенного варианта атомной абсорбции.
Скорость конкретной индикаторной реакции зависит от многих параметров: температуры, ионной силы раствора, концентрации мешающих компонентов, наличия ингибиторов и активаторов. Все эти параметры в кинетических методах анализа необходимо строго контрфолировать и поддерживать постоянными для получения надежной аналитической информации.
Каталитическая реакция является результатом протекания ряда элементарных процессов, поэтому влияние температуры на скорость процесса не всегда легко интерпретировать. Для практической оценки влияния температуры на скорость реакции используют температурный коэффициент ![]() , который показывает, во сколько раз увеличивается скорость реакции при возрастании температуры на 10 К:
, который показывает, во сколько раз увеличивается скорость реакции при возрастании температуры на 10 К:
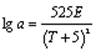 ,
,
Кинетическим определениям могут мешать посторонние ионы и соединения:
· обладающие каталитической активностью;
· снижающие скорость каталитической реакции или изменяющие направление ее отдельных стадий. Мешающее влияние оказывают окислители и восстановители, взаимодействующие с реагентами индикаторной реакции и катализатором: Mn(VII), Cr(VI), I2, ![]() ,
, ![]() , HS ; анионы и соединения, образующие с катализатором каталитически неактивные комплексы — F ,
, HS ; анионы и соединения, образующие с катализатором каталитически неактивные комплексы — F , ![]() , NH3,
, NH3, ![]() , ЭДТА; ионы переходных металлов, проявляющие каталитическую активность — Fe, Cu, Mn, Ti, Co; ионы металлов, образующие комплексы с реагентами и продуктами реакции — Al, Bi, Zr, Ti, TR и др.; ингибиторы и активаторы — в основном органические вещества, взаимодействующие с промежуточными продуктами реакции или с катализатором — оксалаты, фенолы, нафтолы, амины, а также инертные электролиты (например, нитраты и перхлораты щелочных металлов) и вещества, обладающие буферным действием.
, ЭДТА; ионы переходных металлов, проявляющие каталитическую активность — Fe, Cu, Mn, Ti, Co; ионы металлов, образующие комплексы с реагентами и продуктами реакции — Al, Bi, Zr, Ti, TR и др.; ингибиторы и активаторы — в основном органические вещества, взаимодействующие с промежуточными продуктами реакции или с катализатором — оксалаты, фенолы, нафтолы, амины, а также инертные электролиты (например, нитраты и перхлораты щелочных металлов) и вещества, обладающие буферным действием.
Избирательность индикаторных реакций характеризуется максимально допустимым содержанием посторонних ионов, при которых относительная погрешность определения анализируемого вещества не превышает заданного значения, например, 0,1.
Кислотность раствора влияет на избирательность определения, если в лимитирующей стадии индикаторной реакции участвует ион водорода, а также в случае образования в результате гидролиза при разных значениях рН гидроксокомплексов, обладающих различной каталитической активностью. Так, каталитически активные комплексы Ti образуются при рН = 3,8, а максимальное содержание каталитически активных ![]() и
и ![]() наблюдается при рН = 1,1 и pH = 2,2, соответственно.
наблюдается при рН = 1,1 и pH = 2,2, соответственно.
Для устранения мешающего влияния посторонних компонентов применяют традиционные для аналитической химии приемы отделения или маскирования мешающих примесей.
Кинетические методы (в том числе и ферментативные) при условии строгого соблюдения условий проведения анализа не уступают другим методам по точности, достаточно экспрессны, легко поддаются автоматизации. В практике аналитической химии эти методы применяют:
Другие рефераты на тему «Экология и охрана природы»:
Поиск рефератов
Последние рефераты раздела
- Влияние Чекмагушевского молочного завода на загрязнение вод реки Чебекей
- Влияние антропогенного фактора на загрязнение реки Ляля
- Киотский протокол - как механизм регулирования глобальных экологических проблем на международном уровне
- Лицензирование природопользования, деятельности в области охраны окружающей среды и обеспечения экологической безопасности
- Мировые тенденции развития ядерной технологии
- Негативные изменения состояния водного бассейна крупного города под влиянием деятельности человека
- Общественная экологическая экспертиза и экологический контроль
