Кинетика химических реакций
K0 - предэкспоненциальный множитель;
e - основание натурального логарифма;
E - энергия активации;
R - универсальная газовая постоянная;
T - температура.
В нешироком интервале температур (до 200 градусов) величины K0 и E изменяются незначительно и их можно считать постоянными. Таким образом, чтобы определить константу скорости при любой температуре необходимо знать величины K
0 и E, которые можно определить графически. Прологарифмируем уравнение (12).
LnK = LnK0 - E / RT (13)
В координатах "LnK - 1/T" график этой функции представляет собой прямую линию.
Для построения графика все данные сведем в табл.2.4
|
K * 103, л / моль * с |
14,29 |
19,73 |
26,53 |
45,24 |
|
T, K |
403 |
406 |
410 |
417 |
|
(1/T) * 10-3, K-1 |
2,481 |
2,463 |
2,439 |
2,398 |
|
LnK |
-4,25 |
-3,93 |
-3,63 |
-3,10 |
По данным табл.2,4. строим график в координатах "LnK - 1/T" (рис.4). Тангенс угла наклона полученной прямой к оси абсцисс определяет E:
tgα = - Е / R (14), E = - R * tgα = - 8,31 * (-13750) = 114263 Дж / моль
Значение множителя K0 найдем из уравнения (13), подставив в него любую пару значений LnK и 1/Т из табл.2.4 Например, при Т = 403 К.
LnК0=LnК + Е / RT1 = - 4,25 + (114263/8,31) * 2,481 * 10-3 = 29,864.
Откуда К0 = 9,33 * 1012 л / моль * с.
Итак, все постоянные в уравнении (12) известны. Находим K5 при
Т = 395 К.
K5 = 9,33 * 1012 * е-114263/ (8.31 * 395) = 9,33 * 1012 * 7,63 * 10-16 = 7,12 * 10-3 л / моль * с
Используя формулу (11), рассчитываем время, за которое 60% вещества превратятся в продукты реакции при 395 K. Так как исходная концентрация вещества равна 1,0 моль / л, тo в искомый момент времени τx текущая концентрация будет
Cx = 0,40 * С0 = 0,40 * 1,0 = 0,40 моль / л.
Отсюда по уравнению (11):
τ = ( (l / C) - (l / C0)) / K5 = ( (l / 0,40) - (l / l)) / 7,12 * 10-3 = 211 с
Итак, при температуре 395 K 60% исходного вещества превратится в продукты реакции за 211 с.
2.3 Работа 3
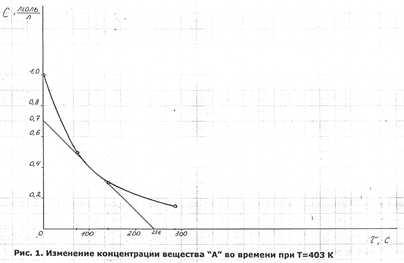
При адсорбции уксусной кислоты из 200 мл водного раствора на 4 г активированного угля при 200C получены следующие данные (табл.2.5).
Установить, каким из адсорбционных уравнений (Фрейндлиха-Зельдовича или Лангмюра) описывается данный случай. Найти постоянные в соответствующем уравнении, а также равновесную концентрацию раствора (C5), если исходная концентрация была равна
C0,5 = 0,56 моль / л (температура раствора 200С, масса адсорбента 4 г).

Решение
Представим данные задачи в виде табл.2.5

Таблица 2.5. Исходные и равновесные концентрации раствора уксусной кислоты при адсорбции на угле
|
Исходная концентрация раствора C0i, моль / л |
Равновесная концентрация раствора Ci, моль / л | ||||||||
|
С0,1 |
С0,2 |
С0,3 |
С0,4 |
С0,5 |
С1 |
С2 |
С3 |
С4 |
С5 |
|
0,080 |
0,130 |
0,270 |
0,520 |
0,560 |
0,058 |
0,098 |
0,218 |
0,447 | |
Уравнение Фрейндлиха для адсорбции из раствора на твердом адсорбенте имеет вид:
Г = К * Сn, (15)
Зельдовича
Г = К * С1/n, (15’)
где Г - адсорбция, т.е. масса адсорбированного вещества на ед. массы адсорбента,
моль / г; С - равновесная концентрация раствора, моль / л; К и n - постоянные при данной температуре. Прологарифмируем уравнение (15).
![]() (16)
(16)
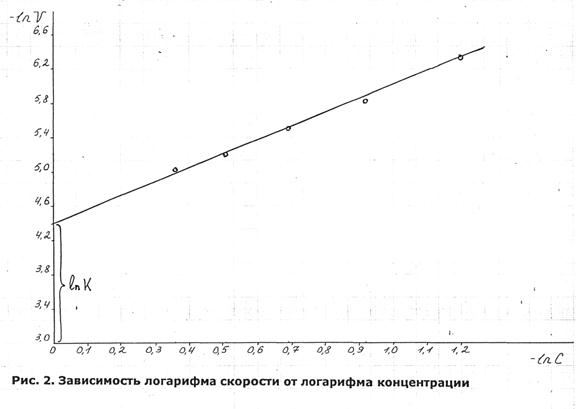
Если адсорбция описывается уравнениями Фрейндлиха-Зельдовича, то в координатах "LnГ - lnC" график функции должен представлять прямую линию. Для проверки высказанного предположения рассчитаем величину адсорбции при различных концентрациях раствора:
Гi = (C0i - Ci) * V / m, (17)
где Г - число молей вещества, адсорбированного из V литров раствора на m граммах адсорбента при исходной и равновесной концентрациях C0i и Ci соответственно.
После подстановки данных задачи (m = 4 г, V = 0,2 л) выражение (17) примет вид:
Гi = (C0i - Ci) / 20.
Найденные по уравнению (18) значения Гi, - вместе с величинами lnCi, lnГi, Ci / Гi сведем в табл.2.6
Таблица 2.6. Данные для построения изотерм адсорбции
|
Исходная концентрация раствора C0i, моль / л |
Равновесная концентрация раствора Ci, моль / л |
Величина адсорбции, Гi * 103,моль / г |
- lnCi |
- lnГi |
|
|
0,080 |
0,058 |
1,10 |
2,847 |
6,81 |
52,7 |
|
0,130 |
0,098 |
1,60 |
2^323 |
6,44 |
61,3 |
|
0,270 |
0,218 |
2,60 |
1,523 |
5,95 |
83,8 |
|
0,520 |
0,447 |
3,65 |
0,805 |
5,61 |
122,5 |
|
0,560 |
----- |
----- |
----- |
----- |
----- |
