Исторический подход к изучению углеводородов в курсе химии средней школы
Воспитательная.
Продолжить формирование у учащихся научной картины мира в процессе изучения теории химического строения органических соединений. Способствовать воспитанию у учащихся активной жизненной позиции.
Развивающая.
Продолжить развитие логического мышления, памяти у учащихся; умений обобщать, делать выводы, устанавливать связь между строением и свойствами веществ. Развивать с
пособность к осознанному пониманию значимости науки химии и объектов её изучения.
ФОУД: урок (с использованием электронного ресурса – презентации).
Тип урока: изучение нового материала
химия школа углеводород урок
Ход урока:
|
Этапы и содержание урока. |
Методы и методические приёмы. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
I. Мобилизующее начало урока. Организация класса, проверка отсутствующих. II. Актуализация знаний учащихся. Факты без теории – не наука! А.М.Бутлеров III. Изучение нового материала. С древнейших времен человечеству известны различные соединения углерода растительного и животного происхождения и некоторые способы их получения и переработки. Например: сбраживая виноградный сок, получали вино, а при его перегонке - спирт; нагревая жир с содой, получали мыло; из цветов извлекали эфирные масла; в Древней Индии, Финикии, Египте для крашения использовали растительные красители – пурпур, индиго, ализарин. Однако в тот период, вплоть до начала XIX в., не делали различия между органическими и неорганическими веществами. В 1807 г. известный уже вам шведский ученый И.Я. Берцелиус предложил выделить изучение веществ растительного и животного происхождения в самостоятельную дисциплину - органическую химию. И.Я. Берцелиуса считают родоначальником органической химии. И.Я. Берцелиус В начале XIX века в органической химии царил полный хаос. Ученые умели определять качественный и количественный состав вещества, но не имели представления о том, как атомы соединяются в молекулы, не пользовались привычными для нас формулами, химические реакции описывали словами, а не уравнениями реакций. К первой половине XIX века в органической химии был накоплен громадный фактический материал, дальнейшее изучение которого тормозилось отсутствием какой-либо систематизирующей основы. Начиная с 20-х годов XIX века стали появляться сменяющие друг друга теории, претендующие на обобщенное описание строения органических соединений. Доструктурные теории. Доструктурные теории непосредственно предшествовали теории химического строения и внутри них были выработаны предпосылки для ее возникновения. Наиболее значимыми теориями были предложенная в 30-е годы немецкими химиками Ю. Либихом и Ф. Велером радикалов, в 40-е заметное место занимала теория типов французских химиков О. Лорана и Ш. Жерара. Как уже было сказано существовали и другие разновидности теорий. Но одни из них не подтверждались (или даже отвергались) экспериментом, другие объявляли «внутреннее строение молекул» принципиально непознаваемым, допускали множественность «рациональных» формул для одного и того же вещества. Ю. Либих Ф. Велер Ш. Жерар На этом фоне следует выделить успешные попытки синтеза органических веществ, а также введение понятия о валентности английским химиком Э. Франкландом. Валентность – это способность атома присоединять или замещать определенное число атомов или групп атомов с образованием химической связи. Представление о валентности было развито немецким химиком Ф. Кекуле. Именно он установил, что в органических соединениях углерод четырехвалентен, а атомы углерода способны соединяться друг с другом в цепочки. Шотландский химик А. Купер предложил вариант написания формул с использованием валентных черточек, на основе которого в дальнейшем был создан современный язык формул. Объективными предпосылками появления теории химического строения явились: а). Введение в химию понятий о валентности и особенно, о четырехвалентности атома углерода, б). Введение понятия об углерод-углеродной связи. - 1853 год –английский химик К. Э. Франкланд ввел понятие валентность. (Валентность-способность атомов присоединять строго определенное число других атомов) -1857 год –немецкий химик Ф. А. Кекуле отнес углерод к четырехвалентным элементам( -С-). в) Идеи о соединении атомов углерода в цепи. -1858 год- шотландский химик А. Купер предположил, что атомы углерода способны соединяться друг с другом в различные цепи. (С-С-С) г). Выработка правильного представления об атомах и молекулах. К. Э. Франкланд А. Купер Ф. Кекуле Важным событием в химии был Международный конгресс химиков ( 1860, г.Карлсруэ), где были четко определены понятия об атоме, молекуле, атомном весе, молекулярном весе. До этого не было общепризнанных критериев для определения этих понятий, поэтому была путаница в написании формул веществ. А.М. Бутлеров считал самым существенным успехом химии за период с 1840 по 1880г. Установление понятий об атоме и молекуле, что дало толчок развитию учения о валентности и позволило перейти к созданию теории химического строения. Свою теорию химического строения Бутлеров изложил 16 сентября 1861 года на 36-м съезде немецких врачей и естествоиспытателей в Шпейере. Он рассматривал молекулу как единое целое, состоящее из отдельных атомов, каждый из которых принимает определенное участие в ее построении и «действует здесь определенным количеством принадлежащей ему химической силы». Бутлеров сказал: «Я называю химическим строением распределение действия этой силы, вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу». Дополняя правило, согласно которому характер сложной частицы определяется природой, количеством и расположением элементарных составных частей, Бутлеров утверждал: «Химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением». Он обратил также внимание на взаимное влияние атомов в молекуле. А.М. Бутлеров Сущность теории химического строения состоит в следующем (основные положения теории): 1. Атомы в молекулах соединены между собой в определенном порядке, в соответствии с их валентностью. Этот порядок соединения атомов называется химическим строением молекулы. Строение молекулы можно установить химическими методами. 2. Атомы углерода могут соединяться друг с другом а) разными по кратности связями: одинарной двойной тройной – C – C – – С = С – – С = С – б) в цепочки разного вида: прямые С – С – С – С, разветвленные
Причем разный вид углеродной цепи может сочетаться с наличием различных по кратности химических связей между атомами углерода, а также связей с другими атомами, например, кислородом, азотом, галогенами. Важный вывод: такая особенность атомов углерода объясняет многообразие органических соединений. 3. Свойства органических соединений зависят: а) от качественного и количественного состава молекулы
б) от химического строения, т.е. порядка связей в молекуле с учетом взаимного влияния атомов.
Вопрос: Как называют такие вещества? Кто впервые предложил этот термин? Важный вывод: анализируя строение молекулы вещества, можно предсказать его свойства, и, наоборот, на основании экспериментального изучения свойств соединения определить его химическое строение. Значение теории и направления ее дальнейшего развития Значение теории химического строения А.М. Бутлерова для органической химии можно сравнить со значением Периодического закона Д.И. Менделеева для неорганической химии Теория строения объяснила неясности и противоречия в знаниях об органических веществах, творчески обобщила достижения в области химии, определила качественно новый подход к пониманию строения соединений, стала основой для объяснения и прогнозирования свойств органических веществ, открыла путь для синтеза новых органических соединений. Отстаивая свое учение о химическом строении, и показывая его практическую значимость, А.М. Бутлеров не считал это учение абсолютным и неизменным. Действительно, если молекула реальность, построенная из реальных атомов, то она должна представлять собой определенное физическое тело в трехмерном пространстве. Конкретную гипотезу о пространственном (стереохимическом) строении органических соединений выдвинул в 1874 г. Я.Х. Вант-Гофф. Идея заключалась в том, что четыре атома водорода (или его заместителя) располагаются симметрично в углах воображаемого тетраэдра вокруг четырехвалентного атома углерода. Я.Х. Вант-Гофф Стереохимия с развитием науки получила прочную физическую основу - с помощью рентгенографии и электрографии стали определять межатомные расстояния и валентные углы, то есть получать картину реального расположения атомов в молекуле. В связи с научной революцией в физике в конце XIX - начале XX веков атом предстал перед исследователями уже не просто неизменным "шариком", а сложной системой. Это позволило американским физико-химикам Г. Льюису и И. Ленгмюру заложить основы теории ковалентных связей, на основании которой валентная черточка классической теории представляет пару электронов!
Электронная теория позволила объяснить и пространственное строение молекул органических веществ, и взаимное влияние атомов, и механизмы химических реакций. V. Закрепление. Тестовая работа (тест раздается каждому ученику в отпечатанном виде). Тест. Теория строения органических соединений. 1. Что входит в состав всех органических веществ? а) кислород; б) водород; в) углерод; г) все перечисленные. 2. Ученый, сформулировавший основные положения теории строения веществ: а) Семенов; б) Бутлеров; в) Фредерик; г) Кекуле. 3. Простейший представитель углеводородов: а) метаналь; б) метан; в) метанол; г) метановая кислота. 4. Углерод в органических веществах имеет валентность: а) 1; б) 2; в) 3; г) 4. 5. Основной тип химической связи в органических веществах: а) ковалентная неполярная; б) ковалентная полярная; в) водородная; г) донорно-акцепторная. 6. Кто ввел понятие «изомерия»? а) И.Берцелиус; б) А.Бутлеров; в) Я.Х. Вант-Гофф; г) Ф. Велер. 7. Термин “органическая химия” ввел: а) М.Бертло; б) Г.Кольбе; в) А.Бутлеров; г) И.Берцелиус. 8. Структурные формулы показывают: а) общее количество атомов в молекуле; б) количество атомов углерода в молекуле; в) последовательность соединения атомов в молекуле; г) расположение атомов в пространстве. 9. Понятие «валентность» ввел: а) А.Кекуле; б) Э. Франкланд; в) А. Купер; г) А.М. Бутлеров. 10. Критерии оценок: “5” – 10 ответов “4” - 8-9 ответов “3” - 6-7 ответов “2” - до 5 ответов IV. Подведение итогов урока. V. Домашнее задание. (По учебнику О.С. Габриеляна) § 4 выучить, ответить на вопросы с. 24 №1, 4, 5, 6. |
Словесный Словесный. Презентация Словесный. Рассказ учителя Наглядный. Презентация Словесный. Доклад ученика, сопровождающийся презентацией. (Справочный материал Диск 1) Словесный. Рассказ учителя, запись в тетрадях под диктовку. Словесный. Сообщения учащихся с демонстрацией портретов учёных. ( справочные материалы - Диск№1) Запись определения учащимися в тетрадях под диктовку учителя. Словесный. Рассказ учителя с использованием демонстрации. Словесный. Сообщения учащихся с демонстрацией портретов учёных. Словесный. Рассказ учителя.
Словесный. Сообщение учащегося с презентацией портрета учёного. Запись в тетрадях основных положений теории. Словесный. Рассказ учителя с использованием презентации Словесный. Объяснение учителя. Словесный Беседа. Наглядный. Демонстрация слайдов. Зарисовка таблиц в тетрадях.
Зарисовка таблиц в тетрадях. Ответы учащихся: Изомеры. Й. Берцелиус. Словесный Беседа. Словесный. Объяснения учителя. Словесный. Наглядный. Рассказ учителя с демонстрацией слайдов презентации. Словесный. Сообщение учащегося с презентацией портрета учёного. Словесный. Рассказ учителя. Пояснения учителя. Самостоятельная работа учащихся. Ответы: 1. в; 2. б; 3. б; 4. г; 5. б; 6. а; 7. г; 8. в; 9. б. 10. Пояснения учителя. Запись д/з на доске и в дневниках | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Другие рефераты на тему «Педагогика»:
- Особенности воспитания единственного ребенка в семье
- Характеристики успешного преподавателя
- Разработка контролирующих тестов по дисциплине "Развитие информационного общества"
- Методика умения ориентироваться на плоскости
- Формирование основ экологической культуры у старших дошкольников средствами игровой деятельности
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения

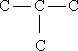 , замкнутые
, замкнутые




