Исследование твердых электролитов
Протоно-проводящие электролиты твёрдые - в осн. кристаллогидраты твердых орг. и неорг. к-т и их солей, в к-рых перенос Н осуществляется либо по сетке водородных связей молекул Н2О (механизм туннельного перехода), либо перемещением иона гидроксония Н3О+ (прыжковый механизм), либо по молекулам, адсорбир. на межзеренных границах поликристаллич. материала. Исключение составляют безводные гидросул
ьфаты и гидроселенаты щелочных металлов (напр., CsHSO4 и CsHSeO4), к-рые приобретают высокую ионную проводимость при т-рах выше структурного фазового перехода, когда число возможных мест локализации протонов оказывается вдвое больше числа самих протонов. Обладают протонной проводимостью и мн. полимерные структуры. Большинство Ag+-проводящих электролиты твёрдые получают либо выращиванием монокристаллов (![]() -Agl, RbAg4I5), либо твердофазным синтезом (RbAg4I5, (C5H5NH)Ag5I6 и др.). Для изготовления Li+-, Na+- и О2- -проводящих электролиты твёрдые используют технологию произ-ва керамики. Существуют полимерные электролиты твёрдые, к-рые обладают пластичностью, из них можно изготавливать тонкие пленки толщиной 0,5-250 мкм. По электропроводности они сравнимы с жидкими и твердыми электролитами (
-Agl, RbAg4I5), либо твердофазным синтезом (RbAg4I5, (C5H5NH)Ag5I6 и др.). Для изготовления Li+-, Na+- и О2- -проводящих электролиты твёрдые используют технологию произ-ва керамики. Существуют полимерные электролиты твёрдые, к-рые обладают пластичностью, из них можно изготавливать тонкие пленки толщиной 0,5-250 мкм. По электропроводности они сравнимы с жидкими и твердыми электролитами (![]() 1-10-3 См/м). Полимерные электролиты твёрдые - как правило, аморфные комплексы полимер-соль или полимер-к-та на. Получают их из полиэтиленоксида (ПЭО) и др. сходных по строению полимеров. Ион проводимости определяется природой второго компонента. При этом ион мигрирует вдоль полимерной цепи благодаря сегментальным движениям полимерной матрицы. Температурная зависимость проводимости комплексов удовлетворяет ур-нию, основанному на теории свободного объема:
1-10-3 См/м). Полимерные электролиты твёрдые - как правило, аморфные комплексы полимер-соль или полимер-к-та на. Получают их из полиэтиленоксида (ПЭО) и др. сходных по строению полимеров. Ион проводимости определяется природой второго компонента. При этом ион мигрирует вдоль полимерной цепи благодаря сегментальным движениям полимерной матрицы. Температурная зависимость проводимости комплексов удовлетворяет ур-нию, основанному на теории свободного объема:
![]()
где Т0 - идеальная т-ра стеклования полимера, Т - т-ра системы, В - константа.
В системе ПЭО-Н3РО4 образуется комплекс (ПЭО) Н3РО4 с n =1,33, обладающий протонной проводимостью ок. 10-3 См/м (298 К). В комплексе ПЭО-NH4НSО4 анионы практически неподвижны и протон переносится катионами![]() (
(![]() 2 x 10-2 См/м). В комплексах ПЭО-LiС1О4 ток переносится как ионами Li+, так и
2 x 10-2 См/м). В комплексах ПЭО-LiС1О4 ток переносится как ионами Li+, так и![]() на подвижность к-рых оказывает влияние неполная диссоциация соли и образование ионных кластеров
на подвижность к-рых оказывает влияние неполная диссоциация соли и образование ионных кластеров![]() и
и![]() Аморфные структуры со св-вами электролиты твёрдые существуют и среди неорг. соединений. Это - стекла, представляющие собой трехмерные сетки, не имеющие строгой периодичности, но сохраняющие ближний порядок в расположении ионов. Такие структуры типа
Аморфные структуры со св-вами электролиты твёрдые существуют и среди неорг. соединений. Это - стекла, представляющие собой трехмерные сетки, не имеющие строгой периодичности, но сохраняющие ближний порядок в расположении ионов. Такие структуры типа![]() -RbAg4I5 обнаружены в смешанных галогенидных системах AgX-CsX и AgX-CuX-CsX (X = С1, Вr, I). Используют электролиты твёрдые в химических источниках тока, ионисторах, хим. сенсорах, в качестве ионселективных мембран, при термодинамич. исследованиях и др.
-RbAg4I5 обнаружены в смешанных галогенидных системах AgX-CsX и AgX-CuX-CsX (X = С1, Вr, I). Используют электролиты твёрдые в химических источниках тока, ионисторах, хим. сенсорах, в качестве ионселективных мембран, при термодинамич. исследованиях и др.
1. Общие сведения
В последние годы все большее внимание привлекают новые твердотельные ионопроводящие материалы (проводники второго рода) с высокой ионной проводимостью: их называют суперионными проводниками (СИП) или твердыми электролитами (ТЭЛ) (в англоязычной научной литературе — superionic conductors, solid electrolytes или fast ion conductors). Как известно, при нормальных условиях ионный перенос в обычных твердых телах — как кристаллических, так и аморфных — не очень значителен и при комнатной температуре проводимость, σ не превышает 10-10-10-12 Ом-1*см-1 [1].
Поскольку ионная проводимость имеет термоактиваиионный характер, то по мере увеличения температуры величина σ растет, однако даже в окрестности точки плавления она редко превышает 10-3Ом-1*см-1 (здесь не рассматриваются эффекты "предплавления" твердых тел, см., например, [2]). Однако аномально высокая ионная проводимость ТЭЛ наблюдается при температурах, существенно более низких, чем температура их плавления. На рис. 1.1 показана проводимость некоторых СИП в сравнении с обычными ионными кристаллами и жидкими электролитами.
Электропроводность "хороших" ТЭЛ составляет 10-1Ом-1*см-1 (при комнатной температуре!), что по порядку величины близко к проводимости расплавов и концентрированных растворов жидких электролитов. Таким образом, речь идет о материалах, сочетающих свойства жидкостей (проводимость, характерная для расплава или раствора, ионная термоЭДС) и твердых тел (механическая жесткость кристаллов).
Первые упоминания о высокой проводимости ионных кристаллов относятся, по-видимому, к началу XIX в., когда в 1833 г. Фарадей [3] отметил аномально высокую электропроводность сульфида серебра, сравнимую со значениями, σ для металлов. Через год, при исследовании фторида свинца, он обнаружил резкое изменение электропроводности кристалла при 450°С [4]; в настоящее время этот эффект известен как фарадеев (размытый) фазовый переход в кристаллах со структурой флюорита.
Первым оксидным ТЭЛ можно считать керамику состава (масс.%) 85ZrO2-l 5Y203, которую Нернст в 1899 г. использовал в качестве материала для ламп накаливания [5]. В 1914 г. при исследовании йодистого серебра Тубандт и Лоренц [6] обнаружили фазовый переход (при 147°С), в результате которого электропроводность скачком меняется более чем на три порядка, достигая величины 1*10-1*Ом*см-1 с последующим слабым ее повышением вплоть до плавления кристалла. Далее проводимость Agl даже слегка уменьшается (примерно на 7%). Следует отметить работы Каммера и Уэбера (1967 г.) [7,8], которые сообщили об электролитических свойствах глинозема и использовании этого материала в серно-натриевом аккумуляторе. В то же время Брэдли и Грин (и независимо от них) Оуэне и Агью [9,10] синтезировали новый серебропроводящий электролит RbAg4I5,проводимость которого при комнатной температуре долгое время была рекордно высокой (0,35 Ом-1* см-1). В настоящее время известно большое количество ТЭЛ, в которых проводимость обеспечивается самыми различными катионами — одно-, двух- и трехзарядными (Ag+, Cu+, Lн+, Na+, К+, Rb+ Тl+, Cs+, Ca2+, Zn2+, Mg2+, Pb2+,Al3+ Sc3+, Ce3+, Eu3+), а также анионами (F-, Сl-, Вr-, О2-, S2-).
Существуют материалы, где носителями зарядов служат одновременно ионы двух сортов, например, Ag2+ и Hg2+ в Ag2HgI4 или сокатионная проводимость в твердых растворах (N,К)-β-Аl2Оз; возможно, ионы трех сортов (К+, Rb+, Сs+) являются подвижными в системах [0,75(l-x)Rb0.7,К0.3FеО2]0,25ТiО2 [11].
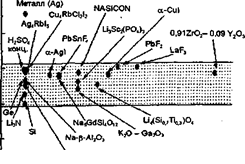
Рис. 1. Электропроводность наиболее интересных ионных проводников в сравнении с жидкими электролитами, полупроводниками, металлами и диэлектриками.
