Возможность улучшения качества учебно-воспитательной работы на уроках химии путем экологизации содержания темы "S-элементы"
2О983Вi + 42α → 21185 At + 210n
или в сокращенной форме
209Bi(α, 2n)211At
Задача 6. Напишите электронную формулу элемента, атом которого содержит на Зd-подуровне один электрон. В каком периоде, группе и подгруппе он находится и как этот элемент называется? Решение. В соответствии со шкалой энергии, 3d-подуровень заполняется после заполнения подуровня 4s
²:
1s²2s²2p63s²3p64s²3d¹
или
1s²2s²2p63s²3p63d¹4s²
Общее число электронов в атоме, которое определяет порядковый номер элемента в периодической системе, - 21. Это скандий. Из электронной формулы видно, что этот элемент находится в четвертом периоде, третьей группе (три валентных электрона 3d¹4s²), побочной подгруппе (элемент d-семейства).
Мои уроки
Настоящая глава посвящена тому, как я провела уроки. Первый урок я провела по традиционной методике, а второй с элементами экологизации.
2.2 Конспект урока по теме: «S-элементы и их соединения»
Цель: характеризовать общие свойства S-элементов ПСХЭ
Задачи:
Образовательные:
1. характеризовать общие свойства s-элементов и зависимость химических свойств соединений s-элементов от свойств атомов;
2. применять знания по общей химии для характеристики элементов и их соединений.
Развивающие:
1. закрепить знания учащихся о распределении электронов в атоме;
2. формировать умения написания электронных формул веществ;
3. формировать умения определять вид ковалентной связи.
Воспитательные: воспитывать умение работать в сотрудничестве, оказывать взаимовыручку и взаимопомощь.
Ход урока:
1. Организационный момент
Добрый день! Сегодня мы начинаем изучение новой темы «S-элементы и их соединения». Для лучшего понимания нового материала необходимо освежить изученный ранее материал.
2. Актуализация знаний
Задание учащимся у доски по карточкам (индивидуальное задание)
№1. Изобразить схему строения атомов и электронную формулу атомов углерода и кремния.
№2. Изобразить схему строения атомов и электронную формулу атомов азота и аргона.
№3. Изобразить схему строения атомов и электронную формулу атомов неона и хлора.
Остальные учащиеся выполняют самостоятельную работу
ВАРИАНТ 1
1. Сколько орбиталей в атоме водорода, на которых находятся электроны?
а) 1; б) 2; в) 3; г) 4.
2. Атом какого химического элемента содержит три протона?
а) B; б) P; в) Al; г) Li.
3. Атом какого химического элемента имеет заряд ядра +22?
а) Na; б) P; в) О; г) Ti.
4. Число нейтронов в атоме марганца равно:
а) 25; б) 29; в) 30; г) 55.
5. Количество неспаренных электронов в атоме серы равно:
а) 1; б) 2; в) 3; г) 4.
ВАРИАНТ 2
1. Сколько орбиталей в атоме гелия, на которых находятся электроны?
а) 1; б) 2; в) 3; г) 4.
2. Атом какого химического элемента содержит десять электронов?
а) S; б) H; в) Ne; г) Li.
3. Атом какого химического элемента имеет заряд ядра +35?
а) Ni; б) Pt; в) Br; г) Te.
4. Число нейтронов в атоме цинка равно:
а) 65; б) 22; в) 30; г) 35.
5. Количество неспаренных электронов в атоме хлора равно:
а) 1; б) 2; в) 3; г) 4.
ОТВЕТЫ
Вариант 1
1 – а, 2 – г, 3 – г, 4 – в, 5 – б.
Вариант 2
1 – а, 2 – в, 3 – в, 4 – г, 5 – а.
Ответы к заданию учащиеся сдают учителю.
Проверка индивидуального задания у учащихся, работавших у доски.
Дополнительные вопросы:
Ø У каких элементов внешний электронный слой завершен? Незавершен?
Ø Сколько электронов не хватает до завершения внешнего электронного слоя?
3. Изучение нового материала
К s-элементам относятся две группы Периодической системы: IА и IIА.
В группу IА входят 8 элементов: литий, калий, натрий, рубидий, цезий, франций, водород, гелий. В группу IIА входят 6 элементов: бериллий, магний, кальций, стронций, барий, радий.
Общим является застраивание в их атомах электронами s-подуровня внешнего энергетического уровня. (Т.Е. говорим о "семействе элементов". ВСПОМИНАЕМ: "семейство элементов" определяется тем, какой подуровень заполняется электронами в последнюю очередь.)
S-Элементы расположены в IIА подгруппе периодической системы Д.И. Менделеева (Это Берилий, Магний, Кальций, Стронций, Барий, Радий). На внешнем электронном уровне у них имеется два электрона, которые легко отдают атомы s-элементов, превращаясь в двузарядные ионы. С увеличением числа валентных электронов на энергеическом уровне энергия ионизации атомов увеличивается (Энергия ионизации - это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома), а следовательно, восстановительные свойства атомов уменьшаются.
Входящие в состав этой группы кальций, стронций и барий издавна получили название щелочно-земельных металлов. Такое название связано с тем, что гидроксиды этих элементов обладают щелочными свойствами, а их оксиды по тугоплавкости сходны с оксидами алюминия и тяжёлых металлов, носивших прежде общее название земель.
Электронная формула внешней оболочки:
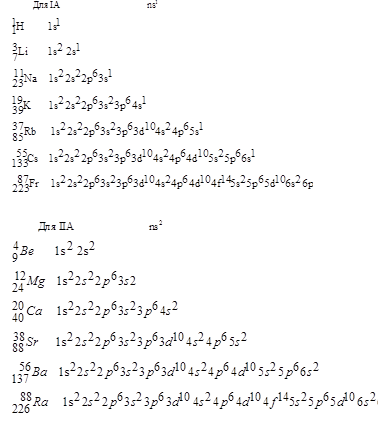
Элементы IIА группы - металлы серебристо-белого цвета, легкие и довольно твёрдые. Они непосредственно соединяются с кислородом, водородом, галогенами, серой, азотом, фосфором и углеродом. На воздухе покрываются защитной плёнкой, которая состоит из оксидов и частично нитридов и карбонатов.
В свободном виде эти металлы получают главным образом электролизом их расплавленных солей. Радий выделяют обработкой урановых руд. В воде катионы s-элементов гидратированы и образуют аквакомплексы ([Ca(H2O)6]2+) за счёт электростатического притяжения дипольных молекул воды. Поскольку электронная оболочка ионов s-элементов имеет устойчивую конфигурацию инетрного газа и лиганды (молекулы воды) мало влияют на состояние электронов, все они в водных растворах бесцветны. Ионы s-элементов в водных растворах могут образовывать комплексные соединения с органическими и неорганическими лигандами, но устойчивость этих комплексов мала, так как s-элементы образуют с лигандами связь, приближающуюся к ионной. Наименьшая устойчивость комплексных соединений наблюдается у ионов с большим радиусом и малым зарядом. У катионов IIА группы с повышением заряда и уменьшением радиуса устойчивость комплексов увеличивается.
Соли элементов IIА группы подвергаются гидролизу в том случае, когда соль образована сильным основанием и слабой кислотой. При растворении такой соли в воде она полностью диссоциирует. Образуется слабая кислота и гидроксид-ионы:
А- +НОН = НА + ОН-
Р-ры таких солей имеют елочную реакцию среды. Гидролиз идёт по аниону.
Другие рефераты на тему «Педагогика»:
- Влияние традиций народной педагогики на развитие нравственной культуры личности младшего школьника
- Использование английских композиторов на уроках английского языка
- Детское движение в современном обществе
- Анализ педагогической деятельности Асафа Мессерера
- Повышение уровня притязаний младших школьников как условие активизации их познавательной деятельности
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
