Моделирование газофазных процессов, протекающих при гетерогенно-каталитическом восстановлении оксидов азота
Результаты и их обсуждение
Влияние энергии активации реакции образования углеводородного радикала на конверсию NO.
Исходными данными для процесса образования углеводородного радикала являлись термодинамические параметры реакции отрыва протона от метана, так как от остальных углеводородов протон отщепить энергетически существенно легче. Следовательно, уменьшая энергию активации, м
ы фактически исследуем влияние на протекание процесса замещения восстановителя в реакции восстановления оксида азота на его гомолог. Это позволит подобрать оптимальный восстановитель. Известно, что чем больше молекулярная масса парафина, тем меньшая энергия требуется для отрыва протона от него.
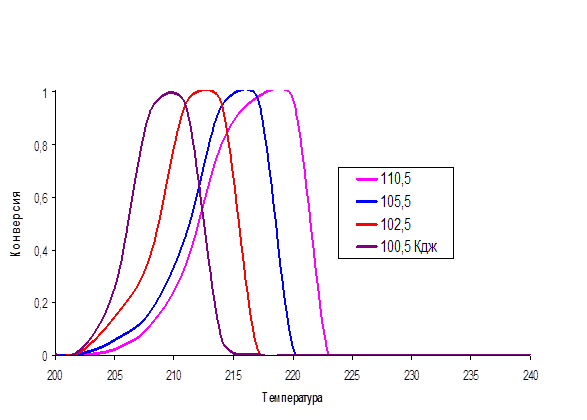

Рис.4 Зависимость конверсии оксида азота от температуры при различных энергиях активации процесса образования углеводородного радикала.
На рис.4 видно, что с уменьшением энергии активации максимум конверсии смещается в область низких температур Этот факт соответствует экспериментальным данным, и, следовательно, подтверждает физический смысл полученной модели.
3.2. Влияние времени контакта на конверсию NO


Рис 5. Зависимость конверсии NO от температуры при различных временах пребывания.
На рис.3 показана зависимость конверсии оксида от температуры процесса. Данная диаграмма иллюстрирует, как меняется температурная зависимость конверсии оксида азота при варьировании временах пребывания, т.е. при варьировании скорости потока. Скорости при восстановлении оксида азота достаточно велики и могут достигать 100000 обратных часов. При времени контактирования равном 0,01 с наблюдается полное восстановление оксида азота уже при ~ 530 К. Дальнейшее увеличение времени контактирования приведет к полному восстановлению оксида азота при еще более низких температурах. Например, при времени контактирования 0,02 с оксид азота уже полностью восстанавливается при 460 K.
3.3. Влияние отношения свободного объема к поверхности катализатора на конверсию NO
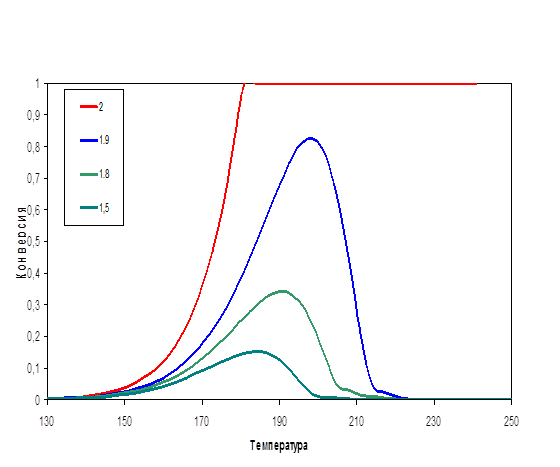

Рис 6.
Зависимость конверсии NO от температуры при различных соотношениях свободного объема катализатора к поверхности
Рис.6 иллюстрирует влияние соотношения свободного объема и поверхности катализатора на температурную зависимость конверсии оксида азота. Отчетливо видно, что чем больше доля свободного объема катализатора, тем большее конверсия оксида. Объясняется это тем фактом, что чем больше доля свободного объема, тем больше образуется активных частиц, взаимодействующих с оксидом азота. С увеличением же доли свободной поверхности количество активных частиц, взаимодействующих с оксидом азота, падает, так как возрастает число их соударений с поверхностью катализатора. Резкий скачок конверсии NO связан с возрастанием концентрации углеводородного радикала. Уменьшение доли свободного объема приведет к тому, что максимум на конверсионной кривой перестанет смещаться, так как при значении соотношения объема к поверхности меньше 0.8 свободный объем уже существенного влияния не оказывает. При увеличении же доли свободного объема конверсия при одной и той же температуре будет увеличиваться
4. Выводы
- Разработана кинетическая модель процесса восстановления оксида азота с учетом процессов, протекающих в газовой фазе.
- Показано соответствие результатов полученных при использовании модели экспериментальным данным.
Установлено, что конверсия оксида азота тем больше, чем больше доля свободного объема катализатора, что свидетельствует о радикальной природе данного процесса.
